-
癌症被认为是细胞的不受控制的增殖,并且细胞的增殖和凋亡活性之间的这种不平衡是一系列遗传变化的结果[1]。肝细胞癌是全世界最常见的癌症之一,在中国患病率特别高[2]。手术切除和肝移植是肝癌传统治疗的主要手段[3]。当前,放射疗法被广泛用于肝癌患者的治疗[4]。然而,放射疗法的应用和功效是有限的,因此需要辅助化学治疗剂来提高患者的存活率。由于其毒性和副作用,大多数可用的天然或合成化合物在临床上均不成功[5]。因此,仍然迫切需要寻找有效且安全的肝癌预防和治疗药物。
灵芝是一种药用菌,是一种名贵的传统中医药,有“仙草”的美称,在我国及一些东亚国家(如日本和韩国)使用了2000多年[6]。灵芝具有抗炎、镇痛、镇静、抗衰老、抑制肿瘤细胞、抗缺氧等功效,通常在临床上用作膳食补充剂或药剂治疗多种疾病,而多糖和三萜类化合物是其两个主要的药理活性成分[7]。灵芝多糖因其具有调节免疫的功效而被研究和报道。最近,本课题组在灵芝多糖研究方面也开展了一些工作[8-9]。而三萜类化合物是灵芝中起到抗癌、产生细胞毒性等多重效能的天然有机化合物药用成分[10-11]。迄今为止,已从灵芝属菌株中分离并鉴定出300多种不同的三萜类化合物,其中灵芝酸A(GAA)是最早鉴定出的三萜类化合物之一[12]。最近的研究表明,GAA通过抑制癌细胞生长、诱导凋亡等方式,对人骨肉瘤[13],淋巴瘤[14],脑膜瘤[15]和乳腺癌细胞[16]表现出抗肿瘤活性。此外,研究还发现GAA还可以增强HepG2细胞(一种典型的肝癌细胞)对顺铂的化学敏感性[17]。
虽然目前关于灵芝三萜药理作用研究很多,但是关于电离辐照条件下它对细胞的作用及效应还鲜有研究报道。已有一些报道可能涉及相关研究,如:雷公藤红素(三萜类物质)可以提高肺癌细胞的辐射敏感性[18],黄芪三萜对肝癌细胞有一定毒性作用[19],但是具体关于灵芝三萜对细胞辐射敏感性的影响及作用机理还不清楚。因此,本文就灵芝酸对癌细胞辐射增敏性影响拟进行初步探讨和研究。在研究中,我们主要考察GAA对人典型肝癌细胞HepG2在辐射下的影响,并采用中子辐射和
$\gamma $ 射线这两种电离辐照方式。其中,中子是不带电的中性粒子,它代表一种中性的、高LET粒子辐射方式,而$\gamma $ 射线代表一种典型的中性、低LET的电磁辐射方式,也是临床放疗的常见放疗手段。通过这项研究,我们期望发现或验证灵芝酸在辐射作用条件下的新功能,或可为癌症放疗辅助治疗提供新的材料、方法和依据。 -
人肝癌HepG2细胞购自美国典型培养物保藏中心(ATCC)。细胞置于含10%胎牛血清、100 U/mL青霉素和100 U/mL链霉素的DMEM高糖培养基中,在37 ℃、体积分数为5% CO2的恒温培养箱中培养。细胞呈贴壁生长,当细胞汇合度达到80%左右时,用0.25%胰蛋白酶消化传代,取处在对数生长期的细胞进行实验。
-
辐照共分成两种方式,第一种是HINEG中子辐照。本实验利用中国科学院核能安全技术研究所/FDS凤麟核能团队的强流氘氚中子源科学装置HINEG产生的14 MeV单能中子进行辐照[20]。HINEG中子源强达6.4×1012 n/s。在辐照试验前,加速器关闭状态时将照射样品摆放完毕。所有接受辐照的样品竖直放置在塑料泡沫板上,与中子靶点呈90°垂直。样品摆放完毕,测量培养瓶细胞贴壁面距离靶点的距离,测量距离3次然后取平均值。根据法诺定理,处于均匀的不带电粒子辐射场中的均匀电离室的空腔可以扩大而仍保持空腔与室壁中的次级带点粒子注量相等[21]。中子在照射过程中可与培养瓶发生作用,在带电粒子平衡条件下,则该处的物质的比释动能K就等于此处物质的吸收剂量。培养瓶的主要成分是聚苯乙烯,通过聚苯乙烯的分子式以及中子 (14 MeV) 能量,可得细胞照射点的中子注量-比释动能换算系数[(μk/ρ)×E ]为5.65×10–15 m2·J/kg,D = K = Φ ×( µk /ρ)× E 。式中, D 为吸收剂量; K 为比释动能; Φ 为中子注量; µk /ρ 为比释动能换算系数; E 为中子能量。通过监测累计中子产额,可以计算出不同组细胞的吸收剂量。
第二种是
$\gamma $ 射线辐照。采用BIOBEAM GM2000型$\gamma $ 射线辐照仪(Gamma-Service Medical,德国),放射源是137Cs密封源,剂量率为2.5 Gy/min。该源在辐照过程中使样品升降和旋转保证受照均匀,辐照时无需任何特殊处理。 -
实验一共分成8组。空白对照组(Sham),不同辐照剂量组(0.3, 0.6, 1.2 Gy),加药对照组(0 Gy+ 5 µmol/L GAA)及不同辐照剂量下加药组(0.3 Gy, 0.6 Gy, 1.2 Gy+5 µmol/L GAA)。根据两种辐照方式(中子和
$\gamma $ 射线),分别进行实验。GAA从MCE (Med Chem Express)公司购买所得。 -
将对数生长期的HepG2细胞制成单细胞悬液,取100 µL细胞悬液于96孔板的孔中 (3 000个细胞/孔),过夜培养,待细胞贴壁后,弃去原培养液,向各加药组细胞分别给予不同浓度的GAA (终浓度分别为0, 5, 10, 20, 40 µmol/L),另外设置空白对照组和不加药对照组,每组设置3个复孔,培养24 h后进行检测,向每孔中加入10 µL CCK-8 (同仁化学,日本) 溶液。将96孔板在37 ℃培养箱内孵育2 h,用酶标仪测定450 nm处的吸光度值,重复实验3次,取平均值。
-
经5 µmol/L的GAA预处理24 h后细胞分别进行中子照射和
$\gamma $ 射线辐照,吸收剂量为0.3, 0.6, 1.2 Gy。电离辐射后,消化细胞并记数。取一定数目的细胞接种于60 mm的培养皿中,置于37 ℃培养2周左右,弃掉培养基,后用PBS清洗两遍,甲醇固定15 min,用8% Giemsa染色,记数大于50个细胞的集落数。细胞克隆存活曲线采用线性二次模型方程Y=exp[–1×(α×X+β×X2)]进行拟合。式中,X为辐照剂量;Y为存活分数;α, β为细胞放射生物学参数,可由Graphpad 8统计软件求出。 -
细胞凋亡检测取对数生长期的HepG2细胞,制成单细胞悬液,接种细胞于35 mm培养皿中,过夜培养,贴壁后弃去原培养液,更换含有5 µmol/L GAA的DMEM培养基,置入培养箱继续孵育24 h;然后对细胞分别进行中子照射和
$\gamma $ 射线辐照,吸收剂量都是0.3, 0.6, 1.2 Gy;辐照结束后继续培养24 h进行凋亡检测。按凋亡试剂盒 (BD,美国) 说明书进行操作,收集细胞,PBS洗涤细胞2次,加入100 µL Annexin V Binding Buffer使细胞悬浮,再加入5 µL的Annexin V-FITC混匀后,加入5 µL的碘化丙啶(PI),混匀;避光、室温反应30 min后,通过流式细胞仪(Beckman,美国)检测细胞凋亡率。用CytExpert(Beckman,美国)软件进行数据分析。 -
将细胞接种于含有无菌细胞爬片的12孔板中(2×104个细胞/孔),每组重复3次。于12 h后更换含有5 µmol/L GAA的培养基,放入培养箱继续孵育24 h;然后对细胞分别进行中子照射和
$\gamma $ 射线辐照,剂量为0.3 Gy,于6 h后采用4%多聚甲醛固定10 min,2% BSA+0.3% Triton X100封闭液室温封闭2 h,$\gamma $ H2AX一抗(1:500)4 ℃过夜孵育,PBS清洗3次,每次5 min,荧光二抗(1:500)室温孵育2 h,用PBS清洗5次,滴加含有DAPI的抗荧光淬灭剂后进行封片。激光共聚焦荧光显微镜下观察$\gamma $ H2AX焦点形成,并计数。 -
每个辐照实验重复3次,并且每次试验设置了3个平行组,每组样品进行凋亡检测至少为3次,试验结果统计后算得平均值,3次辐照实验的平均值以Turkey多重比较检验对照。实验数据资料的组间差异分析均采用单因素方差分析。P<0.05为差异有统计学意义,P<0.01为统计具有显著性差异。统计和绘图均通过Graphpad 8软件完成。
-
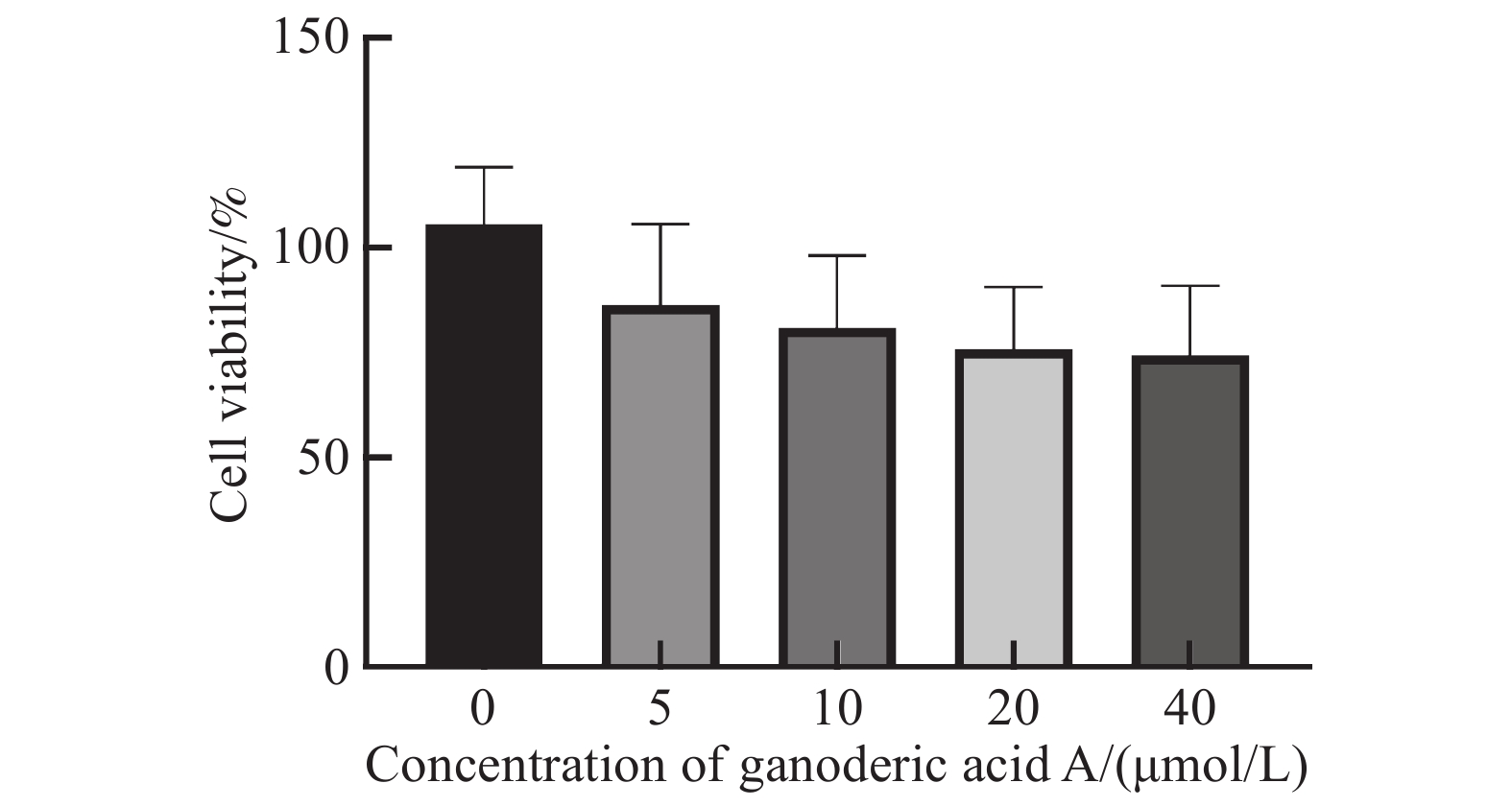
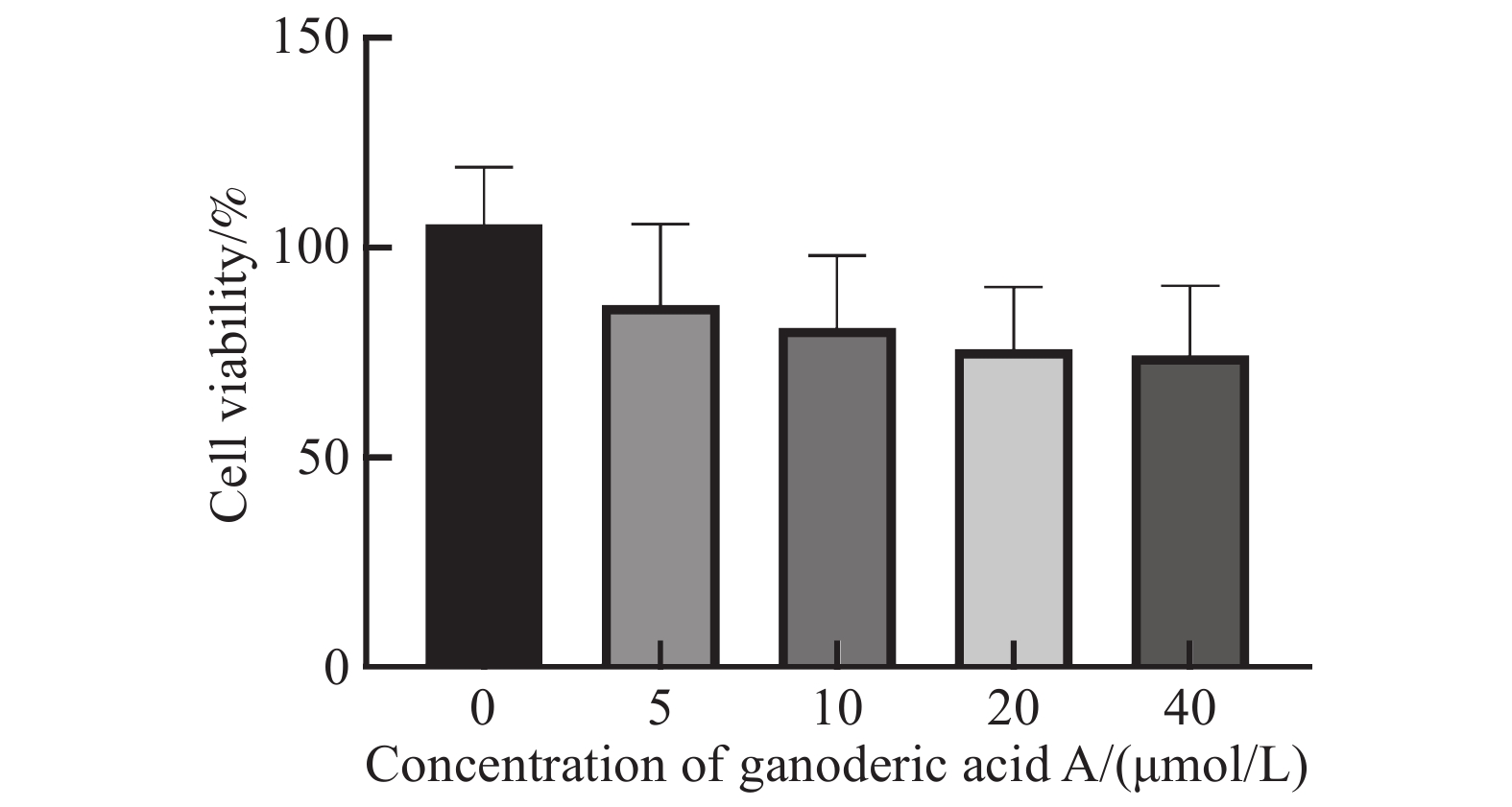
GAA对肝癌细胞HepG2增殖活力的影响使用CCK-8进行检测。结果发现,GAA可以抑制细胞生长,并表现为浓度依赖性,随药物浓度 (0~40 µmol/L) 的增加呈活性抑制趋势。通过计算得到IC10约为(5±0.2) µmol/L,以下实验我们统一使用5 µmol/L浓度作为后续辐照实验的药物干预浓度,见图1。
-
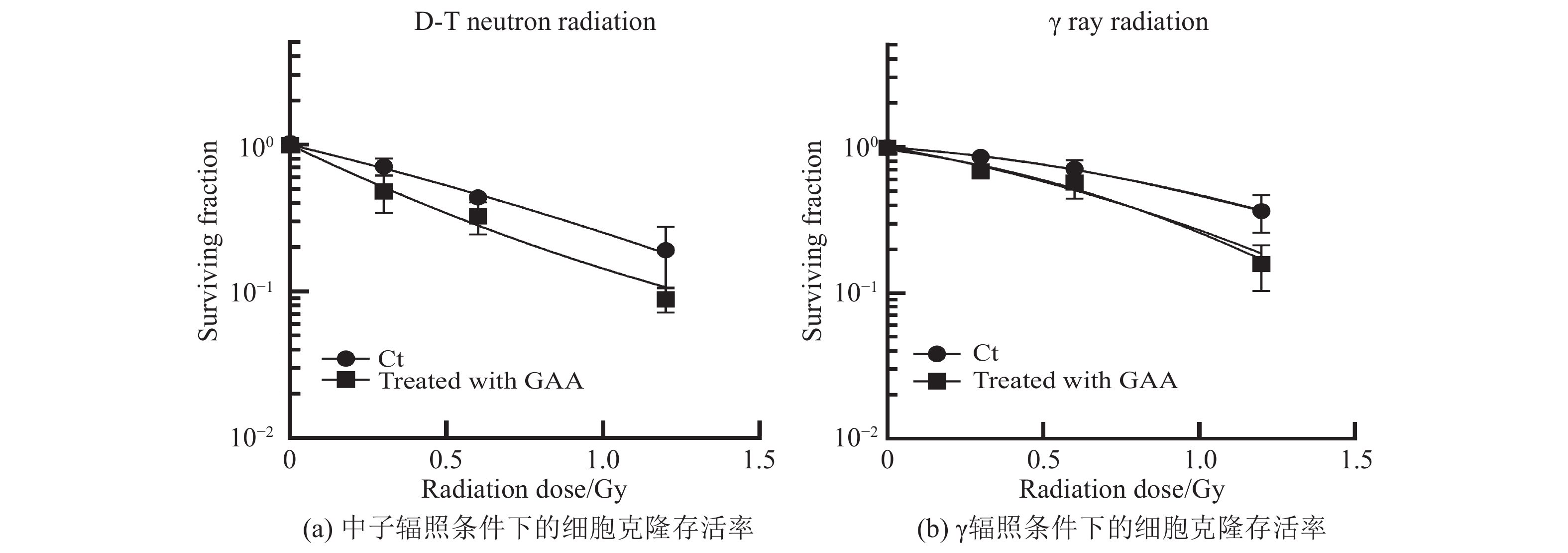
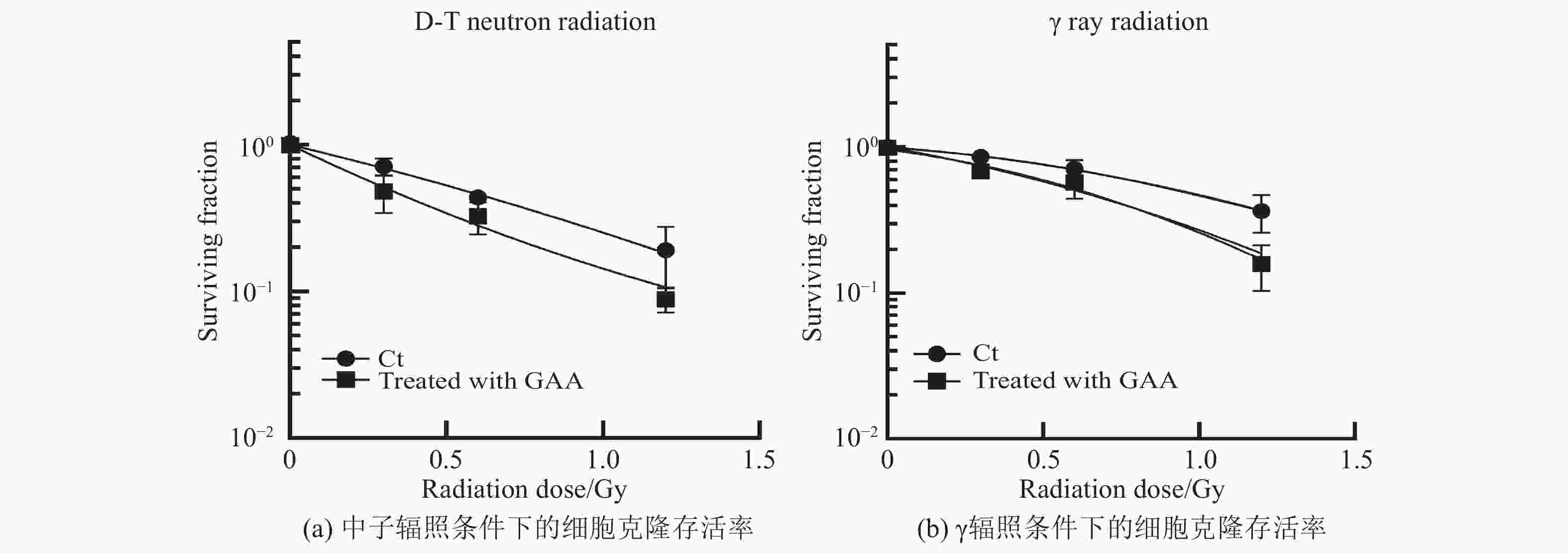
非药物处理组细胞在两种辐照方式下,克隆存活率有一定差异。中子辐照1.2 Gy剂量组细胞存活显著低于
$\gamma $ 辐照1.2 Gy剂量组细胞存活。而使用5 µmol/L浓度GAA预处理的细胞在中子辐照和$\gamma $ 辐照后,细胞存活率均随辐照剂量的增加而减少,表现出辐照剂量依赖性,见图2。经过5 µmol/L浓度GAA处理通过两种方式辐照后,其诱导的细胞克隆存活率均显著低于相应的对照组。通过统计各实验组的细胞存活分数(SF值),将$\gamma $ 辐照组的SF的平均值比上中子辐照组的SF平均值,得到其相对生物学效应(RBE)值。计算得到,对照组的中子RBE值为1.57,GAA处理组中子RBE值为1.65。结果表明,通过添加GAA处理细胞,均能显著降低两种辐照条件下的克隆存活率,具有增加辐射敏感性的作用。 -
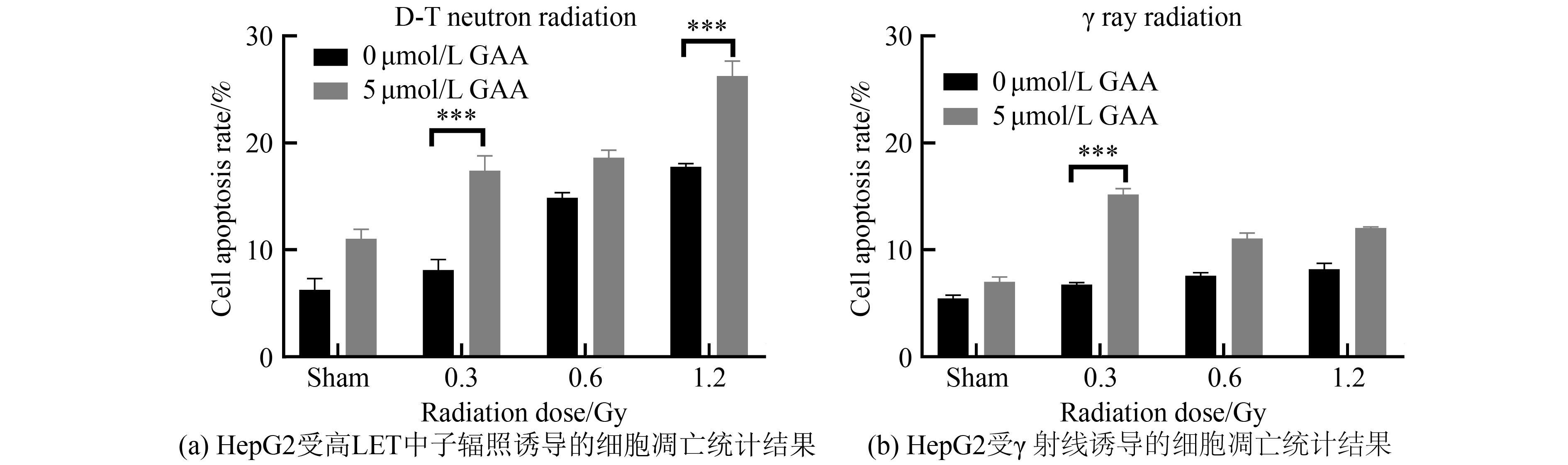
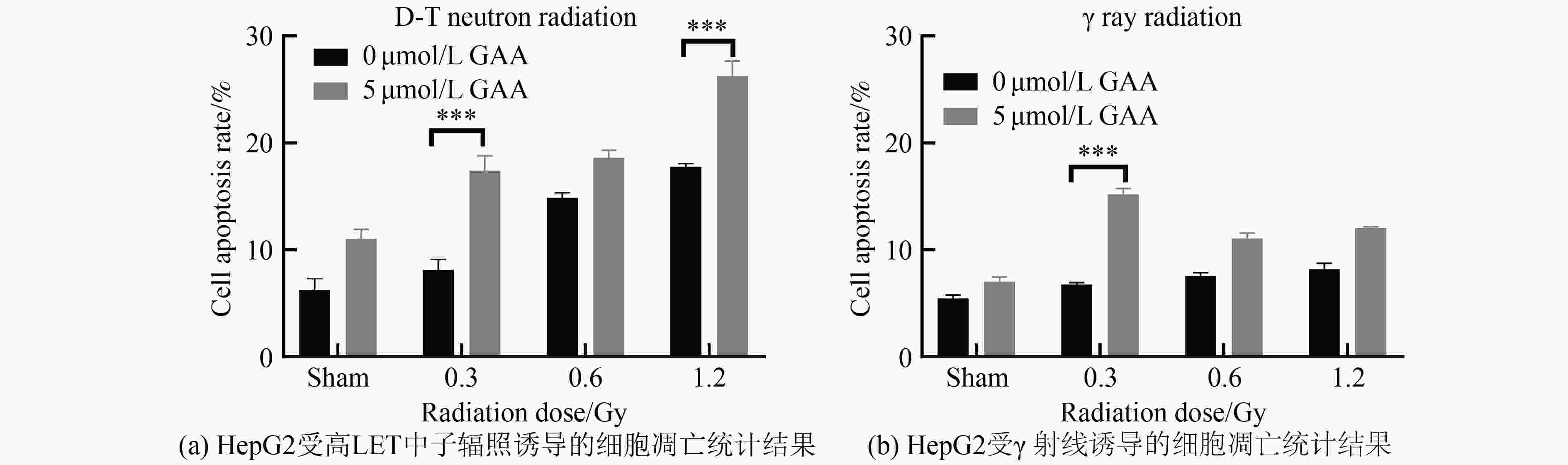
通过使用流式细胞术检测经γ射线或中子辐照后24 h时肝癌细胞的凋亡情况。在GAA未处理细胞的情况下,高LET中子辐照对HepG2细胞的凋亡比例随着辐照剂量的增加而显著性增加;同时,在
$\gamma $ 射线辐照细胞后,凋亡比例有一定增加,但差异性不显著,见图3。在GAA预处理细胞的条件下,分析辐照后24 h时细胞凋亡的变化比例。结果显示,高LET中子辐照对HepG2细胞的凋亡比例随着辐照剂量的增加而增加,并且发现在0.3 Gy时,加GAA组与未加药组相比,加药处理组凋亡比例显著性多于未加药组;而在
$\gamma $ 射线辐照细胞后,也发现在0.3 Gy剂量下,GAA组与未加药组相比,细胞凋亡比例有显著性增加。通过流式检测发现,高LET中子辐照组细胞的凋亡比例是显著高于$\gamma $ 射线辐照组,这也与中子具有高LET特性是相吻合的。 -
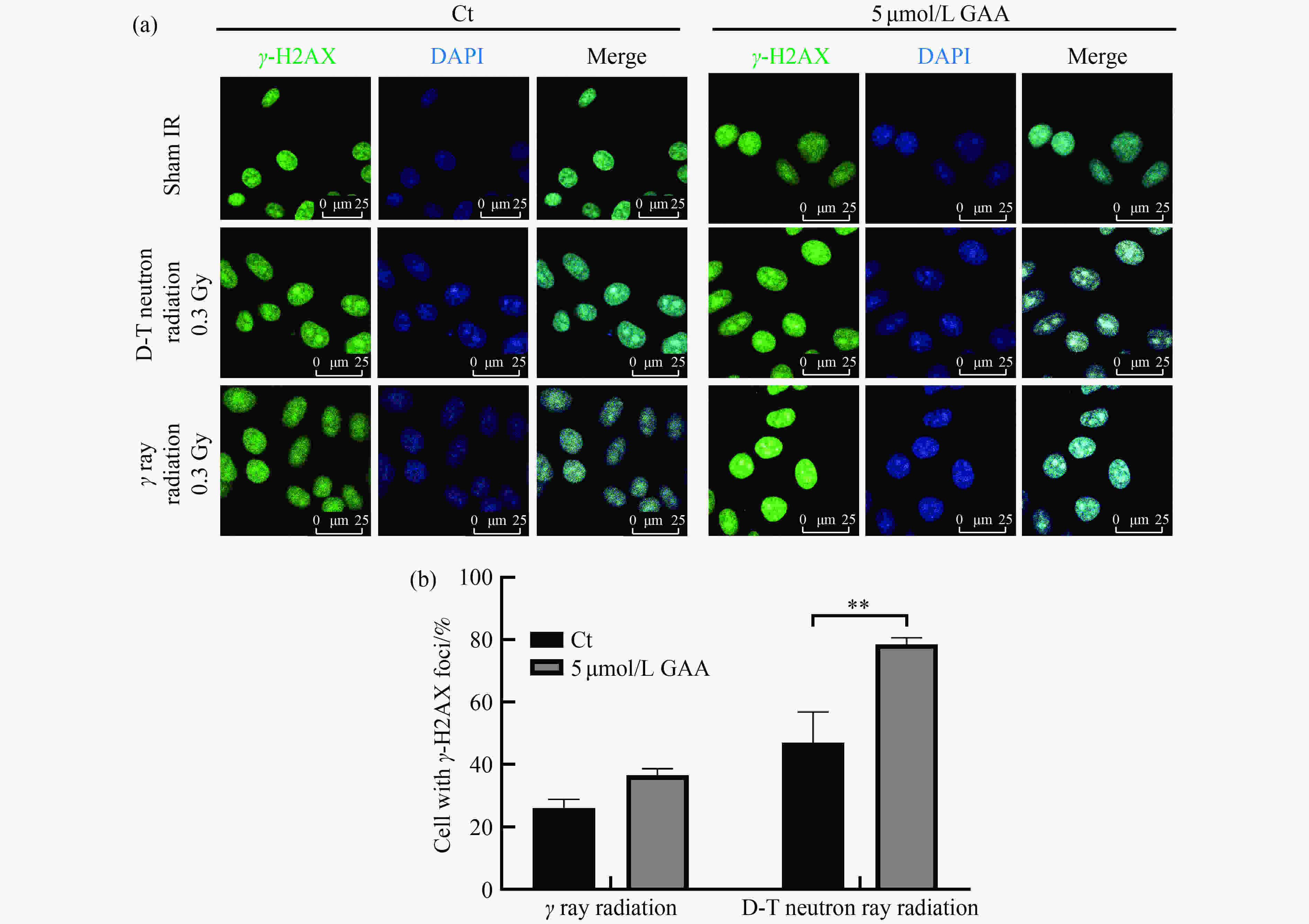
荧光显微镜下观察
$\gamma $ H2AX的foci形成,并计数。在非辐射对照组中,也有少量的$\gamma $ H2AX蛋白的foci形成。在辐照组细胞中表达$\gamma $ H2AX的数量较非辐照组显著性增多。在中子辐照条件下,GAA预处理细胞组与未加药处理组相比,$\gamma $ H2AX的foci形成显著性增多(P<0.05);在$\gamma $ 射线辐照条件下,GAA预处理细胞组与未加药处理组相比,$\gamma $ H2AX的foci形成增多但差异性不显著。通过比较两种辐照条件下的$\gamma $ H2AX的foci形成数量,发现中子辐照条件下的$\gamma $ H2AX的foci形成数量比$\gamma $ 射线辐照条件下的数量显著性增多,如图4所示。 -
近年来,大量研究发现我国传统中药中有很多成分对肿瘤有很好的杀伤和辅助治疗作用。灵芝作为我国传统中医药的药用菌,包含的天然化合物的药用用途非常广泛,其中灵芝酸也有抗癌等功效,如:有研究显示灵芝在小鼠模型中具有抗癌活性,并且在体外研究中具有细胞毒性作用[22],口服灵芝三萜提取物可显著降低暴露于致癌物的小鼠的结肠肿瘤形成和炎症[23],灵芝提取物处理癌细胞可下调细胞周期相关蛋白,从而导致细胞周期停滞[24],灵芝三萜使HCT-116 p53+/+ (野生型)细胞停滞在G1期,而HCT-116 p53-/-缺失型细胞周期停滞在S/G1期,证明了三萜物质可能通过P53基因阻滞细胞周期从而抑制细胞增殖[25]。但是因为灵芝酸种类多,研究过程中提纯和分析有一定的难度[26-27],所以要准确阐明各种灵芝酸的功效及药理还有一定难度。此外,人们发现灵芝与放疗相结合,可以对肿瘤治疗有着很好的辅助作用[28],但是有关机理尚待阐明,而灵芝酸是否在此过程起作用也不清楚。我们在调研中发现,有研究报道指出GAA可以增强HepG2细胞对顺铂的化学敏感性[17]。受此启发,我们提出,灵芝酸对辐射敏感性是否也有类似增强效果呢?为此,我们对GAA对肝癌细胞辐射敏感性的影响开展了初步研究。
通过研究,我们揭示了GAA的辐射增敏作用。实验结果表明:(1) 在不加GAA的情况下,不同辐射方式的生物效应不同。在小辐照剂量范围内,中子辐照相对于
$\gamma $ 射线辐照对肝癌细胞引发的细胞损伤更强,诱导的细胞凋亡比例较多。(2) 在添加了GAA后,与未加GAA对照组相比,诱导细胞凋亡的比例明显增加;特别是在中子辐照条件下,发现在0.3 Gy剂量下凋亡比例显著增加了40%,并随着剂量的增加凋亡比例进一步增加(如:在1.2 Gy条件下凋亡比例与对照相比,显著增加了50%);同样,在$\gamma $ 射线辐照下,添加GAA后对细胞的辐射损伤增大,尤其在0.3 Gy辐照剂量下,加药处理细胞后细胞凋亡比例显著性上升。同样,通过检测细胞克隆存活率,我们也发现在辐射Sham对照组中,细胞克隆存活率随着辐照剂量的增加而显著降低;加GAA预处理细胞后进行辐射,发现细胞的克隆存活率也随着辐照的剂量的增加而降低。这与我们检测到的细胞凋亡的实验结果一致。研究中,我们使用了粒子辐射和电磁辐射两种不同形式的辐照方式,并对此加以比较。其中,中子辐照是粒子辐照方式,中子是不带电荷的中性粒子,它的穿透力非常强。硼中子俘获疗法(BNCT)也是中子临床治疗肿瘤的较好的方法[29]。也有报道使用高能DT融合中子发生器,研究了暴露于融合辐射下的正常人成纤维细胞中的DNA损伤及其调控[30]。而
$\gamma $ 射线是一种高能电磁波,可以通过多种放射性核素释放,也具有较强的穿透力,是临床上常用的放疗手段[31]。有关$\gamma $ 射线辐射生物学研究报道较多,如$\gamma $ 射线缩短小鼠的寿命等[32]。对于原核生物,$\gamma $ 射线也会对细菌细胞的DNA造成损伤和产生毒性[33]。显然,对于不同的辐射方式,辐射生物效应也是不同的。为了定量比较,一般可以用辐射的高线性能量转移值,即LET值加以区别。相比$\gamma $ 射线,中子属于高LET辐射方式,其LET数值为20 keV/µm,而$\gamma $ 射线是低LET辐射,LET数值为0.4 keV/µm。在相同辐照剂量下,高能中子的LET是$\gamma $ 射线的50倍。高LET辐射在能量沉积上有Bragg峰的特点[34-35]。因此,中子辐照和$\gamma $ 射线在GAA作用下的辐射生物学效应差异是可以理解的。通常人们用DNA损伤修复、细胞周期调控、细胞凋亡及相关信号通路转导等考察和分析细胞辐射敏感性[36]。本工作还初步探讨了GAA对辐射敏感性的影响及相应的早期过程和效应,特别是对凋亡的影响,而凋亡检测是研究辐射生物学效应的重要方法之一,也可以作为生物学效应的早期过程的一个评判标准[37-38]。关于早期过程,它可以从原初的物理化学过程一直到包括细胞特征性的辐射生物学效应(包括凋亡)出现。而早期效应甚至是指受到照射后数周之内发生的效应[39]。凋亡过程包括一系列的特定的细胞形态学变化。这些形态学变化中常伴随着生物化学反应的发生,如:启始Caspase酶和效应Caspase酶的激活、线粒体细胞色素C的释放、质膜磷脂酰丝氨酸的外化、多聚(ADP-核糖)聚合酶PARP的降解和核DNA的断裂等[40]。以辐照后的细胞存活率作为生物学终点,研究GAA对辐照后细胞的辐射敏感性。通过分析实验结果,发现在中子辐照和
$ \gamma$ 射线辐照条件下,通过添加GAA后能够增加细胞的辐射敏感性。另外,我们也初步分析了加药后对辐射条件下肿瘤细胞的DNA损伤修复的影响,通过添加5 µmol/L的GAA预处理细胞后,在两种辐照条件下均照射0.3 Gy的剂量,发现肿瘤细胞的$\gamma $ H2AX蛋白的foci形成均有显著性的增加现象,说明在0.3 Gy剂量下添加GAA对肿瘤细胞有一定的增加辐射敏感性作用,这个现象也与凋亡检测的结果较一致,推测可能灵芝酸能通过介导细胞凋亡信号通过促进细胞凋亡,在低剂量辐射条件下出现超敏现象[41]。在本研究中还发现,每组HepG2细胞在两种辐照方式下吸收相同剂量的辐照,但是出现了不同的凋亡比例的变化。对于不同辐射方式,相对生物效应来说,更合适的一种比较方式是采用相对生物效应(RBE)进行比较,因为RBE值更能反映出实验中辐射引起生物效应的实质变化。我们参考郭传玲等[42]提供的RBE值计算方法,通过计算各自的存活分数(SF值)后,将
$\gamma $ 辐照组的SF平均值比上中子辐照组的SF平均值,可以得到中子的RBE值。其中对照Ct组中子的RBE值是1.57,而GAA处理组的中子RBE值是1.65。通过查阅文献进行比较,发现Kim等[43]的实验结果里中子辐照与$\gamma $ 射线进行对比后计算RBE值,其中U2OS细胞的中子RBE值为1.8,KHOS/NP细胞的中子RBE值是1.55。Vandersickel等[44]的研究结果中,与X射线相比Ku70i细胞的中子RBE值是1.95。徐照等[45]研究发现中子辐照与$\gamma $ 射线相比,通过计算得到高能中子的RBE平均值是1.25。本实验所得的对照组的RBE值是1.57,加药处理细胞组的RBE值是1.65。通过与前人的文献进行对比后,我们所得的RBE结果是比较接近的。RBE值并不是固定的,它与细胞种类、参照辐照的选择等都有关系[42]。另外,在灵芝酸药物浓度的选择上,我们考虑到体外实验测定药物放射增敏作用时,通常采用不敏感、低细胞毒性的药物浓度即(IC10值)进行放射增敏实验。这种浓度选择方法,在辐射增敏剂对多种肿瘤细胞系放射增敏研究中得到采用[46]。所以我们采用IC10值(5 µmol/L)的药物浓度进行两种辐射条件下GAA对肝癌细胞辐射敏感性的研究。总之,通过本研究,我们发现灵芝酸预处理肿瘤细胞后,在高LET(高能中子辐照)和低LET(
$\gamma $ 射线辐照)的条件下均有促进肿瘤细胞凋亡的现象,GAA在低剂量辐照条件下有较好的辐射增敏作用。由于乏氧癌细胞对中子射线较为敏感,具有较高传能线密度的中子射线也可以用于放射治疗中具有一定的优势。肝癌细胞放疗敏感性低,易产生放射抗性,而加大放射治疗的剂量不仅会使肝癌细胞产生耐受,而且会加重患者的并发症和副作用。虽然我们这项研究工作刚刚起步,其中还有许多机理方面的问题待进一步研究,但是就目前观察到的现象已经显示灵芝作为一种天然药物或可为癌症放疗辅助使用,即灵芝酸有潜力成为一种低毒有效的辐射增敏剂辅助用于临床;同时,这项工作也为下一步开展机理研究提供了一定的依据和线索。
Preliminary Research on the Radiation Sensitizing Effect of Ganoderic acid A on Human Hepatoma Cells
doi: 10.11804/NuclPhysRev.37.2019055
- Received Date: 2019-10-23
- Rev Recd Date: 2019-11-12
- Publish Date: 2020-03-01
-
Key words:
- ganoderic acid /
- liver cancer cells /
- neutron /
- $\gamma $-ray /
- radio-sensitivity /
- linear-energy-transfer (LET) /
- radiation
Abstract: The aim of this study was to investigate the effect of ganoderic acid A (GAA) on the radiosensitivity of human hepatoma cell line HepG2 for high-LET neutron and low-LET gamma-ray radiations. In this research, the CCK-8 method was used to detect the inhibition of proliferation of HepG2 cells treated by GAA. It was found that 5 μmol/L GAA treatment had weak proliferation inhibition effect on HepG2 cells, and so this concentration of GAA was applied to the cells for 24 h in the subsequent experiments. CCK8 assay, clone formation assay, apoptosis assay, and the foci formation of
| Citation: | Changsheng SHAO, Qunxia ZHANG, Jianye WANG, Qing HUANG. Preliminary Research on the Radiation Sensitizing Effect of Ganoderic acid A on Human Hepatoma Cells[J]. Nuclear Physics Review, 2020, 37(1): 97-103. doi: 10.11804/NuclPhysRev.37.2019055 |
















































 甘公网安备 62010202000723号
甘公网安备 62010202000723号 DownLoad:
DownLoad: