-
随着养殖业、畜牧业、生物工程和饲料产业的不断革新发展,以酵母为原料的各类饲料产品开发利用已成为饲料工业的重要部分。饲料酵母,是一种用于畜禽类饲料的酵母菌体,酵母蛋白饲料富含蛋白质、核酸、维生素及微量元素等多种益生成分,且含有消化酶和酵母多糖等生长刺激因子[1-3]。能够提高家畜新陈代谢,增加适口性,有利于动物消化吸收,加速生长发育,同时还能提高幼畜的抗病、防病能力,减少饲料用量,从而降低生产成本[4-6]。通常认为有以下几个途径发挥功效:(1) 通过改善动物体内胃肠道环境,稳定pH值,促进动物体内益生菌的繁殖,从而促进胃肠道对营养物质的消化吸收;(2) 酵母作为益生菌能够在动物胃肠道体内繁殖,参与病原菌的竞争,排斥病原菌在肠道内的附着;(3) 酵母细胞壁内葡聚糖能够起到提高免疫力,促进动物体内巨噬细胞的形成,巨噬细胞通过吞噬作用吸收、破坏和消除体内损伤、衰老细胞及病原微生物。
我国自20世纪80年代以来就对饲料酵母进行了研究,中国科学院渔业研究所选育的霉菌-酵母混合培养物,其粗蛋白质量分数达到44.1%,广东生物研究所以玉米皮渣为原料配其他玉米蛋白粉等,以玉米粉和麸皮为主要培养基原料的固体发酵温度30 ℃,发酵周期66 h,发酵产业粗蛋白含量达到20.56%[7]。国外饲料蛋白酵母质量分数约为40%~60%,主要集中于高附加值水产业[8]。我国是世界上最大的养殖生产国之一,传统饲料远不能满足飞速增长的饲料需求,尤其是低成本的蛋白质原料匮乏已成为阻碍我国畜牧、养殖业健康发展的主要问题之一[9-10]。因此,获得稳定高产蛋白的菌株,能够显著提升饲料中蛋白含量,提高动物消化、吸收能力,进一步提高动物免疫力,降低动物发病率[11-13]。
相较于其它物理、化学育种手段,重离子辐照诱变作为一种高效的物理诱变方法,具有:传能线密度 (LET)大;能量沉积过程中,末端形成明显的能量损失峰(Bragg峰)更易于实现定向育种;损伤修复效应小,突变体稳定快;相对生物学效应(RBE)高,可产生大量突变体等特点[14]。重离子辐照诱变技术已广泛应用于生物辐射育种,并获得了大量研究成果。Wang等[15]利用重离子辐照诱变技术选育得到1株高产酿酒酵母菌株T4,该突变株较原始菌株产酒精能力提高了18.6%;Ma等[16]利用重离子辐照诱变技术选育得到1株高产蛋白的面包酵母菌株100G-24,该突变株较原始菌株蛋白质量分数提高了13%。Wang等[17]利用重离子辐照诱变技术选育得到一株高产蛋白产朊假丝酵母Y-2-B,其蛋白质质量分数达到38.26%,比诱变前的19.99%提高了41.3%。经过文献调研,重离子辐照诱变选育高产蛋白饲料酵母未见报道。基于上述研究基础,本文拟利用重离子辐照技术对出发菌株NJ3236进行辐照,并结合筛选方法,以期选育得到蛋白含量提高的稳定优良突变菌株。通过优化甜高粱茎秆汁液及玉米浆干粉等培养基配比,进一步提高蛋白产量,满足工业化饲料生产需求。
-
饲料酵母菌株(菌株编号:NJ3236)为中国科学院近代物理研究所生物物理实验室保存。
-
葡萄糖(AR)、酵母抽提物(AR)、蛋白胨(AR)、硫酸铵(AR)、硫酸镁(AR)、磷酸氢二钾(AR)、考马斯亮蓝试剂盒(Solarbio公司)、木瓜蛋白酶(Solarbio公司)、琼脂、硫酸铜(AR)、硫酸钾(AR)、硫酸(AR)、氢氧化钠(AR)、对硝基苯酚(AR)、乙酸(AR)、乙酸钠(AR)、甲醛(AR)、乙酰丙酮。
YPD液体培养基:酵母提取物(1%)、蛋白胨(2%)、葡萄糖(2%)。
YPD固体培养基:酵母提取物(1%)、蛋白胨(2%)、葡萄糖(2%)、琼脂(2%)。各培养基115 ºC下饱和蒸汽灭菌20 min。
-
实验所用到仪器及设备如表1所列。
仪器名称 型号 生产厂家 重离子研究装置 HRIFL 中国科学院近代物理研究所 双人单面超净工作台 SW-CJ-2FD 苏州苏洁净化设备有限公司 台式低速离心机 3-5N 上海安亭科学仪器厂 电热恒温培养箱 WPG-600 上海一恒科学仪器有限公司 电热恒温摇床 HZQ-X300 上海欣蕊自动化设备有限公司 恒温干燥箱 DHP-9705 上海一恒科学仪器有限公司 pH计 PB-1 北京赛多利斯仪器系统有限公司 电子精密天平 BSA623S-CW 北京赛多利斯仪器系统有限公司 高压蒸汽灭菌锅 LDZF-50L 上海申安医疗器械厂 凯氏定氮仪 KDN-2C 上海昕瑞仪器仪表有限公司 紫外可见分光光度仪 SP756PC 上海光谱仪器有限公司 微孔板分光光度计 EPOCH BioTek 安捷伦公司 超声细胞破碎仪 JY92-IIN 宁波新芝生物科技股份有限公司 -
兰州重离子加速器国家实验室中国科学院近代物理所TR4浅层终端提供的束流参数:重离子束流为12C6+,能量80 MeV/u,穿过菌液的平均LET为35.5 keV/μm,辐照剂量为40, 80, 100, 120 Gy。
(1) 种子培养及初筛
将平板上单菌落挑取一环接入50 mL三角瓶中,50 mL三角瓶装液量为20 mL,摇床培养温度30 ºC、转速210 r/min,培养12 h,以5%接种量接入发酵培养基中,相同条件下培养24 h。发酵结束后,对菌液进行离心(4 000 r/min,10 min)、洗涤3次、称重后,配置10%的菌悬液,加入0.15%木瓜蛋白酶,55 ºC恒温水浴12 h,离心,取上清液利用考马斯亮蓝法(BCA法)测定其吸光度,计算可溶性蛋白浓度[18]。
(2) 突变株复筛
将初筛得到的突变株培养24 h,离心(4 000 r/min,10 min),洗涤3次干燥后,利用GB/T6432-2018饲料中粗蛋白测定方法--凯式定氮法测定蛋白含量。
称取0.5 g恒温干燥后过100目的粉状酵母菌体,加入硫酸铜与硫酸钾粉末混合物,置于消化管中,加入浓硫酸后,放置于消化炉中进行消化,待消化管中溶液完全澄清为蓝绿色后取出;在定氮仪中,蒸馏消化液约150 mL,并用浓度为0.100 0 mol/L的盐酸标准液进行标定,并计算蛋白含量[1]。
蛋白质量百分比测定:
$\text{酵母菌体中蛋白百分含量} = \dfrac{({V}_{1}-{V}_{2}) N\times 0.014}{m\times 10}\times F\times 100\text{%,}$ 其中:V1是样品消耗盐酸标准液体积;V2是试剂空白消耗盐酸标准液体积;N是盐酸标准液的浓度;m是样品质量;F是氮换算为蛋白的系数。
(3) 突变株遗传稳定性实验
对复筛得到的蛋白含量高于原始菌株的突变株进行遗传稳定性实验,挑取斜面保藏菌株,并对其可溶性蛋白含量进行测定,共传代9次,确定高产突变株的遗传稳定性。
(4) 发酵培养基优化
选择廉价的碳、氮源是降低生产成本的关键,甜高粱汁、玉米浆粉已广泛应用于工业化生产,具有良好的理论实践基础,甜高粱汁液作为碳源与玉米淀粉、糖蜜作为原料具有原料预处理简单,设备需求量少,能够为企业节省生产成本;且甜高粱汁液中蔗糖、果糖、葡萄糖均为可发酵性糖[19],酵母菌可直接利用,发酵效率高,糖转化率高等优势。玉米浆粉作为一种新型氮源,主要含有微生物所需的蛋白质、氨基酸、活性多肽、及多种维生素及微量元素等,且玉米浆粉价格低廉,相较于牛肉膏或酵母抽提物等有机氮源价格优势明显,能够为企业降低生产成本。硫酸镁中镁元素作为微生物合成代谢多种酶的活化剂,能够促进碳水化合物的合成代谢,是多种酶的激活剂(己糖磷酸化激酶、异柠檬酸脱氢酶、羧化酶等)的激活剂,从而提高微生物糖转化率。选取上述三种物质作为单因素进行研究,并对其配比进行响应面优化实验,确定最优发酵培养基配方[19-21]。发酵培养基单因素试验如表2所列。
因素 水平 −1 0 +1 甜高粱汁浓度/(g·L−1) 15 20 25 玉米浆粉浓度/ (g·L−1) 10 14 18 硫酸镁质量浓度/(g·L−1) 1.2 1.6 2.0 -
本实验数据采用Origin2021绘制图像,SPSSStatistics 18.0进行方差分析,实验重复3次,显著性水平P<0.05,差异显著。
-
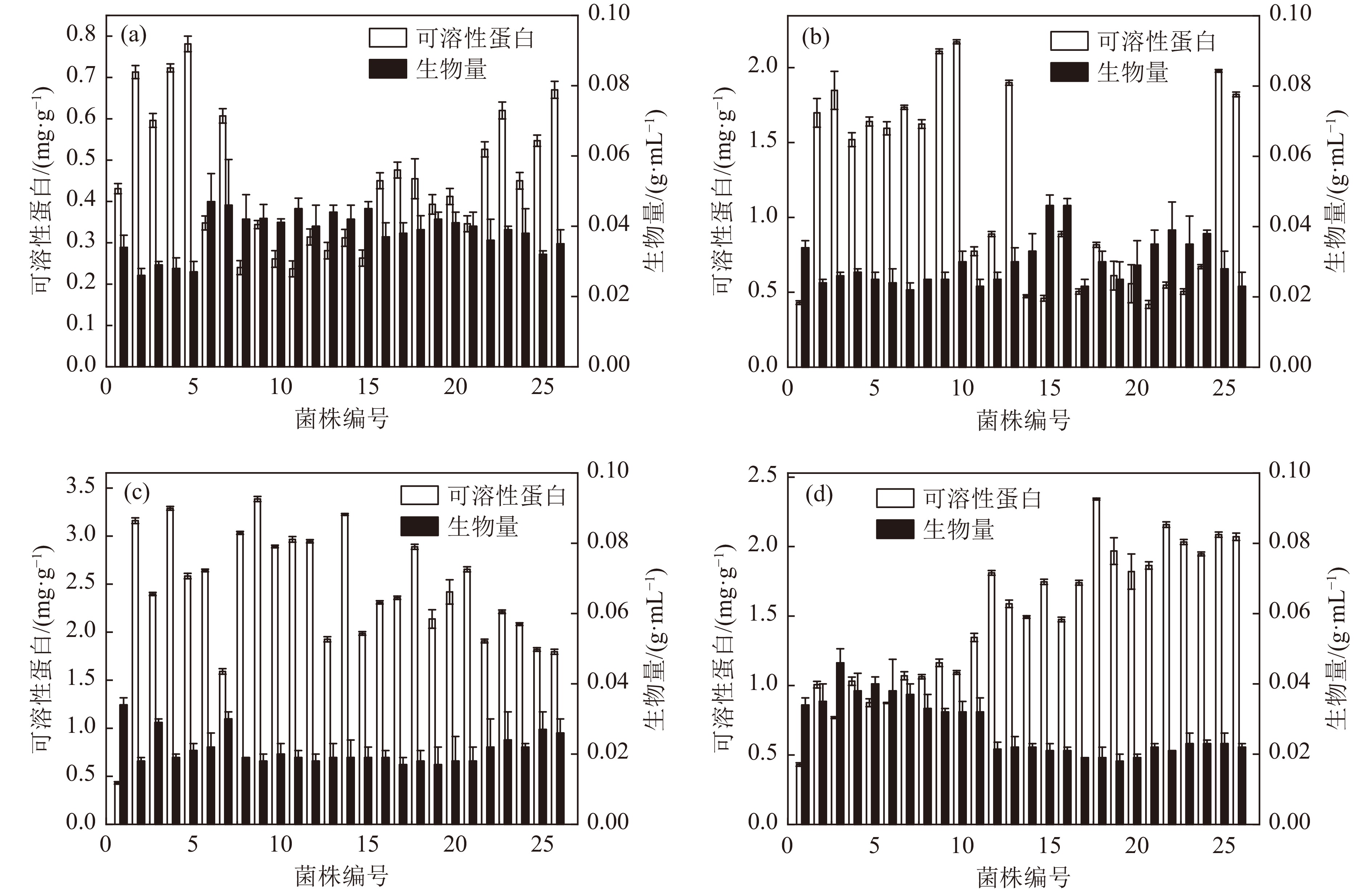
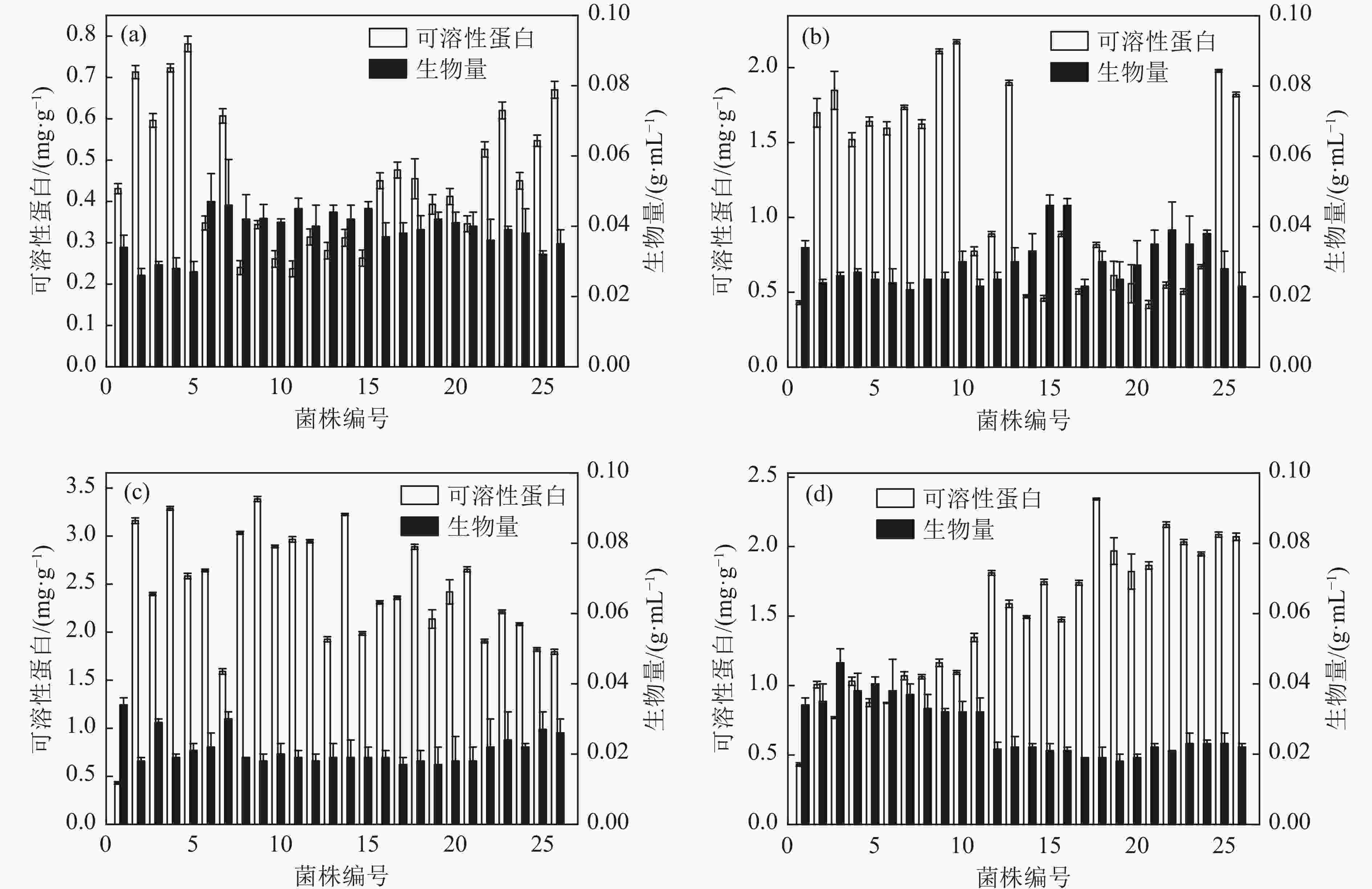
原始对照菌株(NJ3236)与辐照剂量为40, 80, 100, 120 Gy的可溶性蛋白及生物量,如图1所示。
NJ3236菌株为0号菌株,初筛标准为大于原始对照菌株(NJ3236)可溶性蛋白50%,且生物量
$ \geqslant $ (0.034±0.05) g/mL为正突变体,由图1(a)所示,蛋白含量提高的突变株共5株,生物量提高的突变株共24株,蛋白含量和生物量均提高的突变株共计4株,正突变率为15.38%。由图1(b)所示,蛋白含量提高的突变株共12株,生物量提高的突变株共12株,蛋白含量和生物量均提高的突变株共计5株,正突变率为19.23%。由图1(c)所示,蛋白含量提高的菌株共25株,生物量提高的突变株共4株,蛋白含量和生物量均提高的突变株共计4株,正突变率15.38%。由图1(d)所示,蛋白含量提高的突变株共20株,生物量提高的突变株共6株,蛋白含量和生物量均提高的菌株共计3株,正突变率为11.54%。在半致死剂量80~100 Gy,筛选得到正突变株的概率较大[22-23]。由图1(a~d)所知,4个辐照剂量生物量提高菌株数量均高于蛋白含量提高菌株数量。生物量的积累主要通过酵母细胞有氧呼吸,利用外界碳源、氮源、及微量元素等以供机体生长所需。在低剂量辐照下,酵母DNA损伤较小,修复产生的错配也相对较少,而低剂量的刺激效应,导致酵母细胞中对营养物吸收增强,三羧酸循环加速,从而使得酵母生物量积累得到提高。通过初筛得到40G-5、80G-25、100G-2、100G-6、120G-11,共计5株,用于复筛。
-
凯氏定氮法测定NJ3236及初筛得到的5株可溶性蛋白含量高的菌株,实验结果见表3。
样本编号 蛋白质量分数/% NJ3236 40.64±0.03 40G-5 40.83±0.05 80G-25 43.10±0.02 100G-2 45.03±0.02 100G-6 42.94±0.04 120G-11 42.28±0.03 由表3可知,5株突变株较原始菌株蛋白质量分数分别提高了0.47%、6.05%、10.80%、5.66%、4.04%,其中100G-2蛋白含量最高。由于重离子辐照诱变后酵母蛋白含量积累机制目前尚不清楚,本研究仅通过国内外研究报道对该机制进行推测,酵母细胞内蛋白的积累主要通过DNA复制、转录、翻译、修饰等过程,Matuoy等[24]研究结果表明高LET辐射会对DNA造成聚集性损伤,而且DNA的大多数聚集性损伤导致DNA中的双链断裂。因此,需要重组修复途经(RAD52途经)来修复碳离子诱导的DNA损伤,Kieliszek等[25]研究结果通过碳离子辐照后,碱基变异主要发生G:C→T:A的转换,而且变异位点主要集中在核小体连接区域附近。DNA在损伤后启动应急机制,对错配基因进行修复,在修复过程中产生大量的突变,从而导致酵母细胞蛋白积累发生变化。也有研究表明,酵母细胞中蛋白含量发生变化与酵母细胞生存机制息息相关,其机制主要包括抑制合成代谢机制过程,该过程主要由提供细胞能量代谢的细胞器线粒体参与完成,当酵母细胞内线粒体受到损伤导致ATP合成受阻,会促进内源性蛋白和致病性蛋白(如;亨廷顿蛋白及
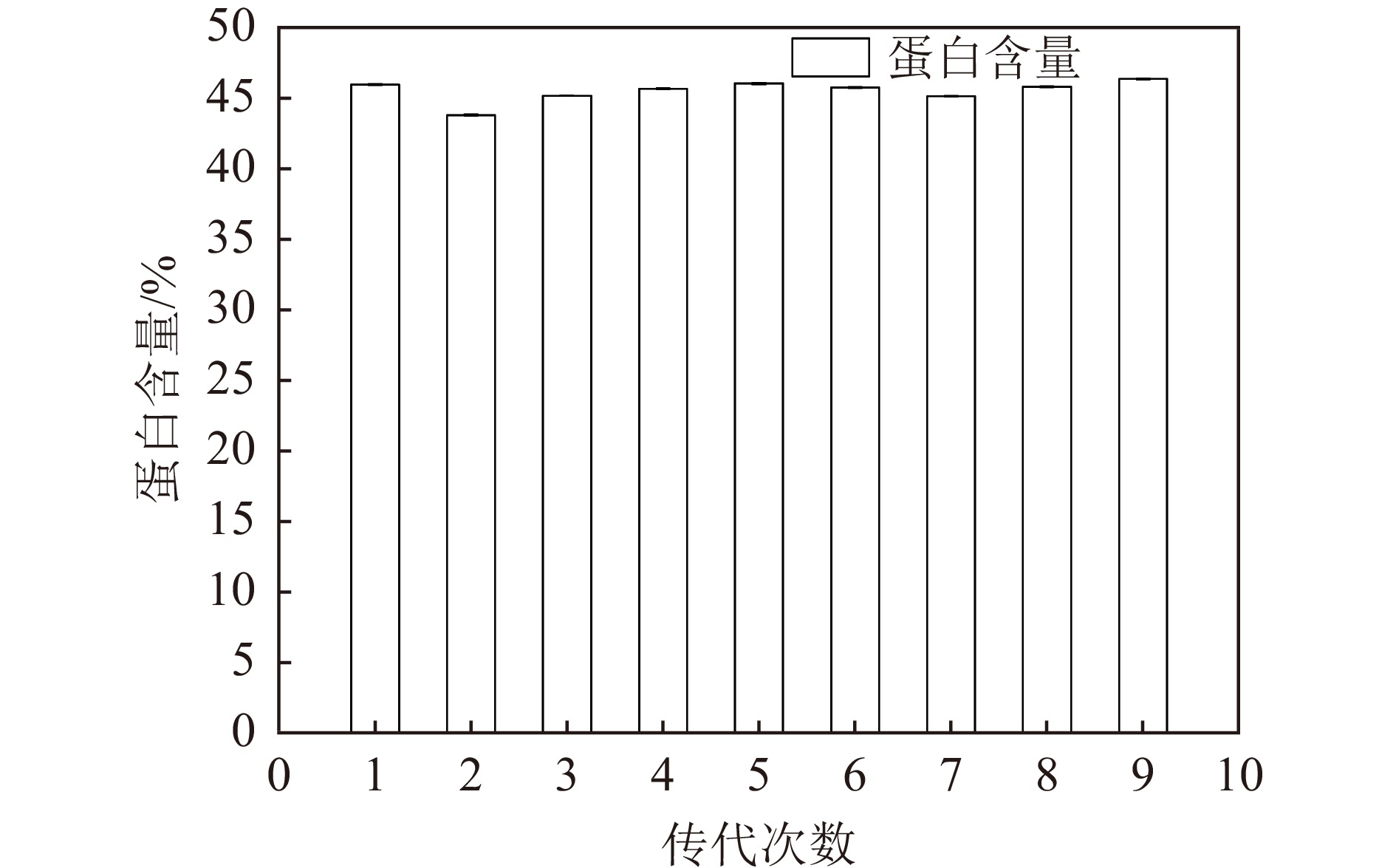
$ \alpha $ -突触核蛋白)的积累,从而抑制酵母细胞的活性[26];因此,酵母细胞内ATP的相对稳定能够确保蛋白质合成、积累的稳定。外界环境的变化如:温度、pH值、溶氧等条件的变化都能使酵母胞内蛋白积累产生相应的应答机制和蛋白变化[27]。以100G-2突变株为研究对象,通过连续传代9次,测定突变株100G-2的蛋白含量,从而确定突变株的遗传稳定性。实验结果见图2。
由图2可知,通过9次传代实验,100G-2突变株蛋白含量稳定,并未发生回复突变,可利用该菌株进行发酵实验。
-
为满足饲料蛋白产业需要,还需通过优化培养基,采用廉价原料,降低生产成本。据美国、巴西对几种作物的酒精产量比较,甜高粱可生产95%(v/v)的乙醇6 000~7 500 kg/hm2,超过木薯、玉米、小麦等近1倍以上。每公顷甜高粱每年的酒精产量达6 106 L,而甘蔗只有4 680 L。利用玉米作原料生产乙醇,每升乙醇需玉米2.4 kg,原料费4.5元,而利用甜高粱每升需秸秆12 kg,原料费仅3元,生产成本大大降低。Worley等[28]比较利用甜高粱和玉米作为原料生产乙醇较之于玉米生产乙醇具有能量方面的优越性。Liu等[29]的研究结果表明,单位面积甜高粱茎秆乙醇提取量明显高于单位面积玉米籽实的乙醇提取量,甜高粱茎秆是生产燃料乙醇优质的生物质能源。Sun等[30]对甜高粱秸秆在不进行灭菌条件下进行固态发酵生产蛋白试验,结果表明,在采用黑曲霉、白地霉组合发酵过程中,甜高粱粗蛋白质量分数由原来的2.01%提高到了21.43%,其粗纤维由12.37%降为2.34%。
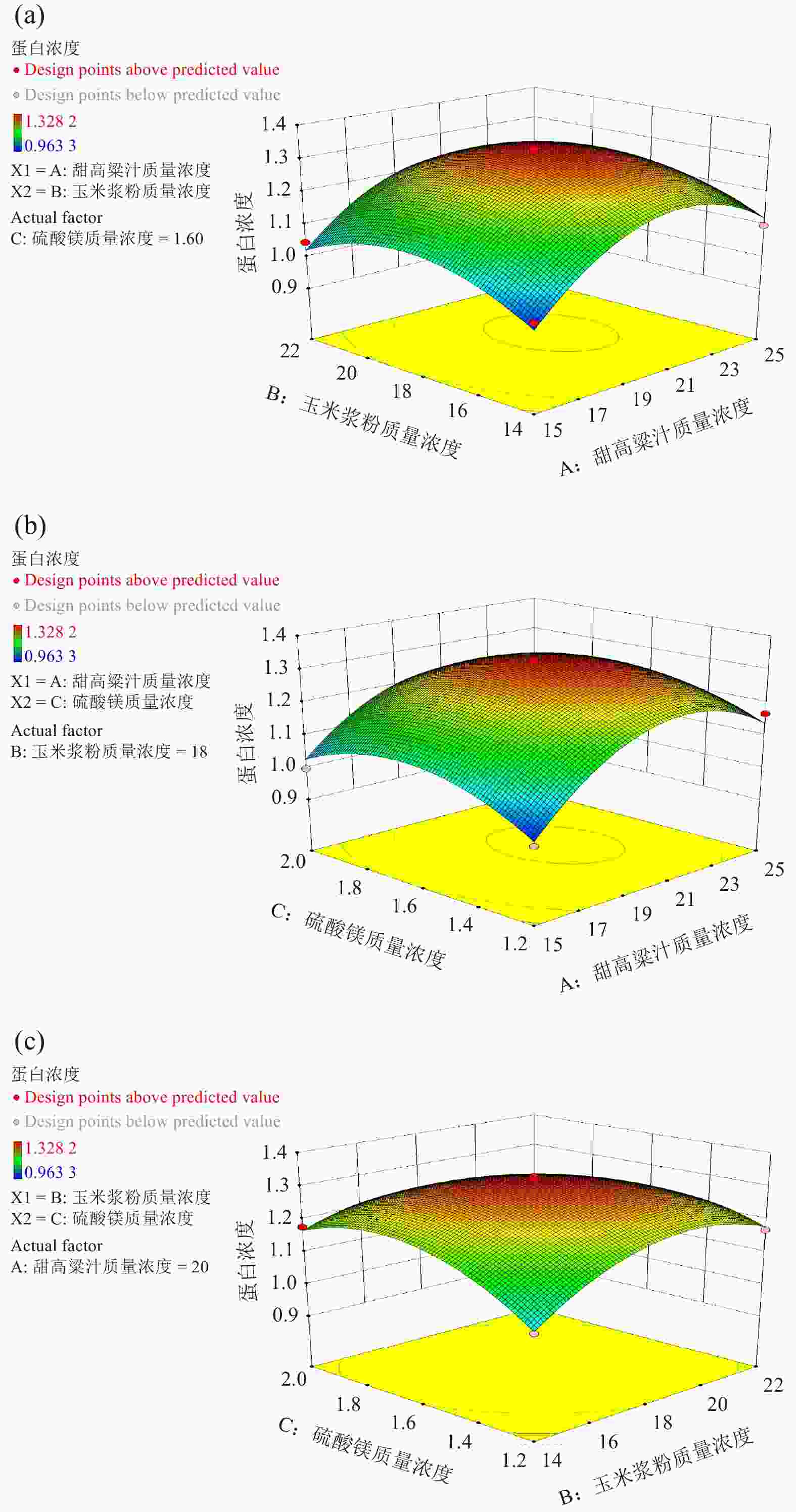
上述实验均以甜高粱为碳源进行发酵,降低了生产成本,提高了发酵效率,而对于饲料酵母发酵培养基优化未见报道,本研究通过单因素实验确定了最优条件,以最优条件为响应面的实验中心点,如表2所列。根据Box-Behnken的中心组合设计原理,设计了三因素三水平响应面分析实验,设甜高粱汁质量浓度为X1,玉米浆粉质量浓度X2,硫酸镁浓度X3,实验设计结果见表4。采用合理的实验设计,确定实验的试验点,实验设计要遵循尽量减少总的实验次数。试验点确定后,按随机原则对每个试验点进行实验,以便于后续的实验统计与分析[31]。
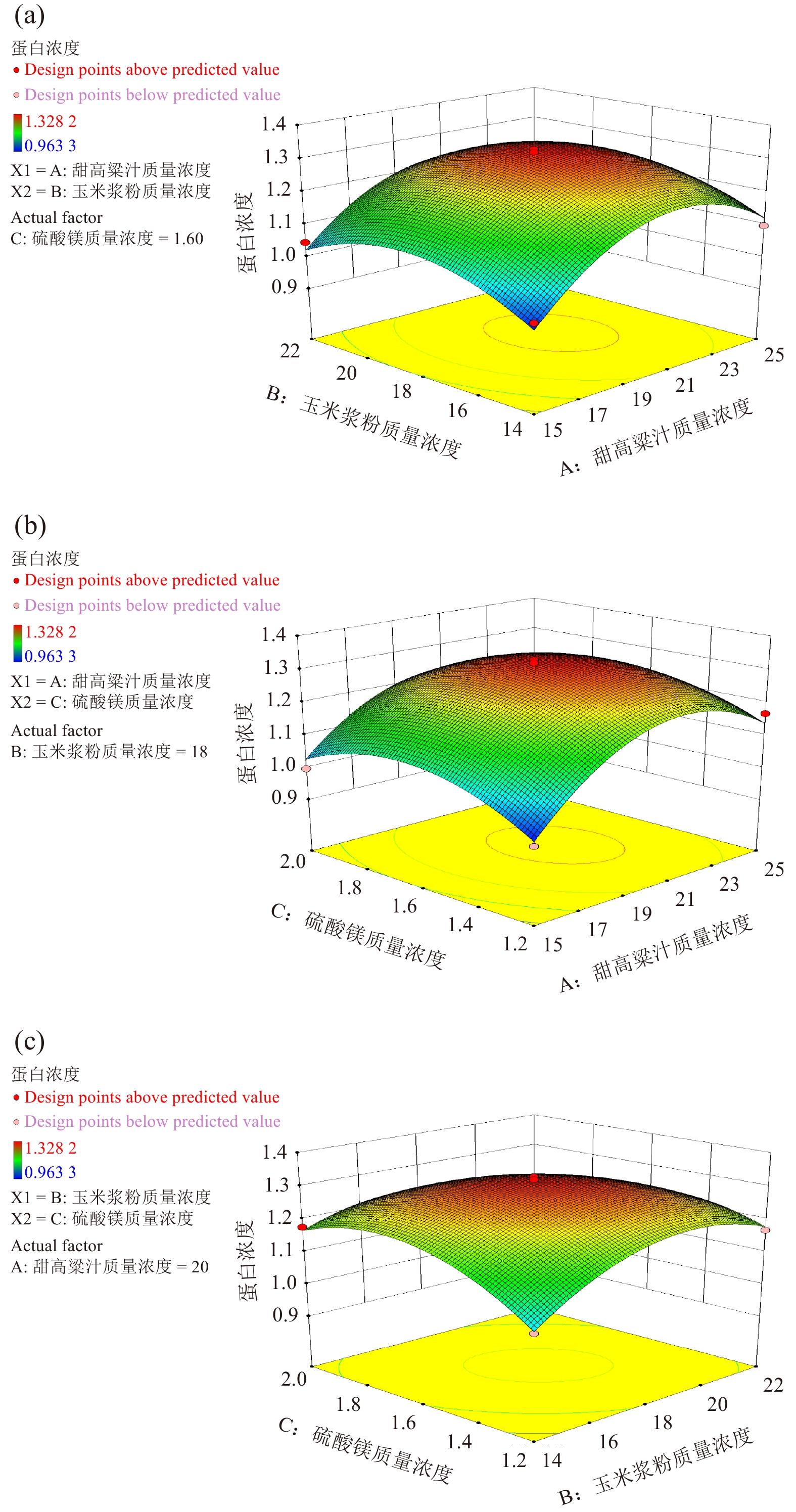
试验号 X1 X2 X3 蛋白浓度/(mg·mL−1) 1 20.00 22.00 1.20 1.168 2 20.00 18.00 1.60 1.320 3 15.00 18.00 1.20 0.963 4 15.00 14.00 1.60 0.997 5 15.00 18.00 2.00 0.997 6 20.00 18.00 1.60 1.314 7 20.00 18.00 1.60 1.319 8 20.00 14.00 2.00 1.177 9 20.00 18.00 1.60 1.300 10 20.00 18.00 1.60 1.328 11 20.00 14.00 1.20 1.046 12 15.00 22.00 1.60 1.047 13 20.00 22.00 2.00 1.086 14 25.00 18.00 2.00 1.119 15 25.00 18.00 1.20 1.168 16 15.00 14.00 1.60 1.098 17 25.00 22.00 1.60 1.100 根据试验结果,利用响应面分析软件对数据进行分析,以蛋白浓度为响应值回归方程表达如下:
其中:Y为蛋白浓度;X1 、X2和X3分别为甜高粱汁质量浓度、玉米浆粉质量浓度和硫酸镁质量浓度,对结果进行方差分析见表5。
变异来源 方差平方和 自由度 均方 F值 P值 模型 0.25 9 0.028 40.84 <0.000 1 A 0.029 1 0.029 42.23 0.000 3 B 0.000 79 1 0.000 79 1.16 0.316 8 C 0.000 14 1 0.000 14 0.21 0.659 3 AB 0.000 59 1 0.000 59 0.86 0.383 7 AC 0.001 7 1 0.001 7 2.55 0.154 7 BC 0.011 1 0.011 16.85 0.004 5 A2 0.1 1 0.10 153.13 <0.000 1 B2 0.042 1 0.042 61.75 0.000 1 C2 0.040 1 0.040 58.97 0.000 1 残余项 0.004 7 7 0.000 68 失拟项 0.004 3 3 0.001 4 13.70 0.014 3 注:P> 0.05表示差异不显著;P< 0.01表示差异极显著。 由表5可知,3个因素中对应的响应值影响的显著顺序为:甜高粱汁质量浓度、玉米浆粉和硫酸镁。由方差分析得出,模型的F=40.84、P<0.000 1,证明模型极显著,失拟项F=13.70、P=0.014 3<0.05表明失拟不显著,二元多项回归方程拟合效果良好。回归决定系数R2=0.981 3,修正决定系数
$R^2_{\rm Adj }= 0.957 \; 3$ ,说明方程拟合性较好,可以应用于对培养基优化的分析预测。根据上述回归方程作出响应面分析图,见图3(a)、3(b)、3(c)。数据分析表明回归模型存在最大值,饲料酵母100G-2产蛋白发酵培养基最优配方:甜高粱汁质量浓度20.95 g/L,玉米浆粉质浓度18.17 g/L,硫酸镁质量浓度1.60 g/L,此条件下理论预测最大值为1.321 mg/mL。验证试验此条件下蛋白浓度为1.381 mg/mL,与预测值相近,证明了模型的可靠性。
-
本实验采用不同剂量的12C6+重离子束,对饲料酵母菌株NJ3236进行辐照,通过初筛、复筛得到突变株100G-2,该菌株较出发菌株NJ3236蛋白质量分数提高了10.08%。为了更好地指导工业化生产需要,本实验通过响应面法分析优化了发酵培养基配方,以甜高粱汁为碳源,玉米浆干粉为氮源,最优培养基配方为甜高粱汁20.95 g/L、玉米浆干粉18.17 g/L、硫酸镁1.60 g/L。实验结果表明,该菌株在利用甜高粱汁进行工业化生产蛋白饲料中具有较大的潜力。
本研究暂未对突变株100G-2的高产蛋白机理进行研究,后续工作中需对突变株100G-2突变株进行全基因组测序分析,与原始菌株比较,初步了解突变位点发生的变化(插入、缺失、颠换),是否具有规律性;并通过KEGG、GO通路,定位到突变位点与代谢通路中蛋白合成的关键基因是否有关联,同时对其合成蛋白通路进行研究,初步了解合成通路中蛋白合成关键酶基因的调节变化,从而为阐明100G-2突变株高产蛋白机理奠定理论基础。另一方面对100G-2 突变株中氨基酸含量及种类进行分析测定,结合饲喂实验,有针对性地提高有利于家畜生长的氨基酸含量,应用于饲料蛋白的实际生产中。
Screening and Breeding of High Yield Strain of Protein Feed Yeast and Optimization of Its Fermentation Process
doi: 10.11804/NuclPhysRev.39.2022063
- Received Date: 2021-09-03
- Rev Recd Date: 2021-11-16
- Publish Date: 2022-12-20
-
Key words:
- heavy ion irradiation /
- feed yeast /
- sweet sorghum juice /
- response surface methodology
Abstract: Protein content in feed is a key index for evaluating feed quality, However, recent reports of determine the protein content of feed on dietary for feeds tuffs investigated as potential sources of protein content (yeast, lactic acid bacteria, etc.) and protein content of the forage. The protein content of feed yeast strains directly determines the protein content of feed, so it becomes the key to obtain good feed yeast strains. In this study, a heavy ion 12C6+ beam with an energy of 80 MeV/u was used for irradiation mutagenesis and breeding of starter yeast NJ3236(protein content of 40.64%), and the strains were screened and rescreened to obtain 100G-2 strain with high protein content. The protein content of the 100G-2 strain increased by 10.08% compared with that of the strain NJ3236. Then response surface analysis was used to optimize the fermentation medium. The optimal ratio of medium showed that sweet sorghum juice 20.95 g/L, corn steep liquor 18.17 g/L and magnesium sulfate 1.60 g/L. Under this condition, the soluble protein concentration reached 1.381 mg/mL, which was 8.7% higher than that before optimization.
| Citation: | Liang MA, Zeya DU, Xiang ZHOU, Jihong CHEN. Screening and Breeding of High Yield Strain of Protein Feed Yeast and Optimization of Its Fermentation Process[J]. Nuclear Physics Review, 2022, 39(4): 512-518. doi: 10.11804/NuclPhysRev.39.2022063 |










 甘公网安备 62010202000723号
甘公网安备 62010202000723号 DownLoad:
DownLoad: