-
放射治疗(简称放疗)作为癌症临床治疗最有效的手段之一,具有杀伤肿瘤细胞、提高肿瘤控制率、保护正常器官的明显技术优势,约70%的肿瘤患者接受放疗治疗[1-2]。从理论上说,提高放疗疗效的最简单方法是以足够剂量的放射线包围并杀死所有癌细胞,同时将周围的正常组织的损伤降到最低[3]。临床实践证实,更高的靶区照射总剂量水平[4-5]或者采用较高的剂量分割模式[6-7]均可以提高肿瘤的局部控制和改善患者生存率。但高发肿瘤大多位于胸腹部,受呼吸、胃肠蠕动等生理现象的影响,肿瘤和周围危及器官存在相对移动现象。由于临床上必须考虑并发症的风险等因素,在涉及到运动靶区和临近靶区存在许多重要危及器官的情况下,在增大放疗总剂量和采用较高剂量分割模式的问题上一直采取谨慎的态度。实时图像引导放疗是解决精准放疗中锁定靶区和周围危及器官位置的主要途径之一。目前放疗中广泛采用锥形束CT作为在线肿瘤位置验证手段来进行精准放疗,但其受到扫描时间长、成像剂量大、组织对比度差的限制[8]。虽然可以采用肿瘤替代物,例如: 膈肌、胸壁等成像表现肿瘤的运动情况,但肿瘤运动与替代物运动的直接相关性尚需数据支撑[9]。另一种方式是在肿瘤中植入金属标记的方式,这种技术需要患者在放疗前接受侵入式手术,而且需确保采用这种侵入性手术对患者具有最大益处[10]。
完成可用于精准放疗图像引导的肿瘤和周围危及器官成像方法必须满足实时性、 高分辨率、对患者影响最小三个特性。因此,磁共振(MRI)成像已成为图像引导的一个重要方向,其具有更好的软组织对比度,不会对患者产生电离辐射。目前已成功将MRI集成到直线加速器上成为新型医用磁共振加速器(MR-Linac),理论上可用于分次内和分次间的肿瘤及其周围危及器官的位置验证,开展磁共振图像引导放疗(MR guided Radiotherapy, MRgRT )治疗[11]。同时,也提出用于肿瘤位置实时定位的2D电影MRI(2D cine MRI)[12]和四维MRI(four dimensional MRI, 4D MRI)[13]的MRI技术。其中 ,4D MRI虽然可以提供靶区和周围危及器官的完整空间和时间信息,但由于其分辨率不高、非实时成像、扫描时间与图像质量互斥等技术瓶颈,使得其无法真正实现放疗实时图像引导[14]。另一方面,2D cine MRI 存在成像层面固定为横断面、矢状面、冠状面三个层面,成像中心固定,无法同时获得高时间和空间分辨率成像等困难,导致其精度有待提升,临床应用受限等情况。
本研究旨在建立一种融合BEV/BPV信息的高分辨率快速磁共振成像方法(3.5D MRI)。选取具有代表性的肝转移瘤作为腹部肿瘤的临床实践和应用,采用3.5D MRI实时成像方法追踪肝转移肿瘤的运动规律,针对器官运动对于放疗的影响进行量化和控制方法研究,将有助于进一步提升在放疗中对于靶区的精准打击和对正常组织的保护。
-
选取磁共振直线加速器 Unity治疗的结直肠癌肝转移的患者,并排除存在放疗绝对禁忌症的患者。患者定位采用西门子CT模拟定位机进行四维CT(4D-CT)图像扫描。采取仰卧位、手臂上举放于头部两侧支撑架上等体位完成CT和MR定位阶段扫描。而后基于扫描图像完成靶区和周围危及器官勾勒,其中GTV(Gross Tumor Volume)是影像学所见的原发肿瘤区,内靶区ITV(Internal Target Volume)是参考影像判断由于呼吸运动、膀胱充盈度、胃肠道蠕动等生理活动引起肿瘤形状、位置大小发生改变的靶区范围,ITV外放5~10 mm得到的区域为计划靶区PTV(Planning Target Volume)。目前常规GTV到PTV的外放边界取决于病变的放射学特征和临床判断,并通过4D-CT考虑分次内的不确定性以及摆位误差。放疗计划采用Monaco V5.4系统制定调强放射治疗(IMRT),射野个数为8~9个。采用磁共振加速器治疗过程中,患者按照常规方案即采用腹部加压带限制腹部运动,并用现有2D cine MR成像持续扫描监督肿瘤位置,以保证剂量输送的准确性。患者在每次疗后,首先使用腹部加压带限制腹部运动(RAM组)扫描3.5D MRI图像,随后让患者处于自由呼吸状态(FB组),扫描3.5D MRI图像。
该成像是在正交核磁共振成像实时采集模式的基础上发展起来的。不同于现有2D cine MRI,该方法所呈现图像的中心完全与射野中心重合,依据肿瘤质心和放疗射野特异性方向生成的三个正交成像平面:一是沿着射线方向的两个射束路径观(Beam Path View, BPV)平面;另一个是垂直于射线方向的一个射束方向观(Beam Eye View, BEV)平面。结合所有射野角度的三个正交层面的磁共振实时成像,该方法可提供涉及射野穿过的靶区和周围危及器官位置变化的准确信息,完成后无需后期处理,可直接提供放疗中最关注层面的图像和重点放疗信息的方法。表1列出了采集3.5D MRI序列的关键参数。
参数名称 参数值 参数名称 参数值 Sequence technique 2D Gradient Echo Sequence Number of dynamics in each gantry 150 Contrast Balanced oversampling 50 mm on both sides The scan time per frame/s 0.23 Gradient mode Default Time per gantry (per dynamic)/s 34.7 Fat suppression No Field strength B0/T 1.5 Halfscan No Relaxation time TR/ms 3.6 SENSE 3 Echo time TE/ms 1.82 Uniformity Clear Bandwidth/ Hz 868.7 Reconstruction matrix 320 Flip angle 60 Reconstruction mode Real-time Field of view 300 mm×300 mm Stacks 3 Fold-over suppression Oversampling Slices in each stack 1 Acquired voxel size 2.3 mm×2.26 mm×6 mm Slice orientations Orthogonal to each other Peripheral nerve stimulation(PNS) mode Moderate Coils used MRL_Posterior and MRL_Anterior 由于一个呼吸周期的长度平均为(3.6±0.8) s,因此在一个特定的射野方向上,每个二维动态的采集时间为 34.7 s,可完全覆盖约10个呼吸周期。研究中的肿瘤运动幅度的变化采用肿瘤附近可替代的解剖结构,如:门静脉、肝叶等。由于3.5D MRI图像中肿瘤边界不明显, 而肿瘤附近的血管显像突出并有明确边界。Jupitz 等[15]的研究证明,肝脏肿瘤的运动与肝脏血管之间存在正相关,血管是用于研究肝脏内肿瘤运动的合适替代物。Rosenbery等[16]已经在一项多机构磁共振引导大分割放疗研究中证实采用肿瘤附近的血管等来追踪原发性肝脏或肝转移病灶该方法的有效性。肿瘤附近可替代的血管的勾画步骤如下:1) 通过同一个角度方向下的同一3.5D MRI成像平面按帧与帧采集时间顺序进行排序;2) 由主管医生在同一个角度方向下的同一成像平面 3.5D MRI 成像集上对第一帧上肿瘤附近的血管进行勾画;3) 找到逐帧之间的变形矢量场(DVF),由采用局部自适应正则化的Demons图像配准算法生成DVF [17],血管轮廓由第一帧通过DVF传递到随后的帧;4) 由主管医生对勾画血管轮廓逐帧验证和修正。每个患者的肿瘤替代物的位置在第i帧中采用二维径向矢量Ri表示,每一帧中肿瘤替代物的振幅是△Ri = Ri−Rmean,其中Rmean是同一个角度方向下的同一3.5D MRI成像集上肿瘤替代物振幅的平均值,用95%置信度下的量化分析。对两组之间的差异进行统计分析,首先用Shapiro-Wilk检验判断差异是否符合正态分布,P>0.05则认为差异的分布符合正态分布。当差异符合正态分布时,可使用配对样本t检验;当差异不符合正态分布,则选择Wilcoxon 检验。
-
图1展示了患者1在射野角度为200°方向上 3.5D MRI 图像示意图。图1(a)和(c)中带箭头的蓝线和图1(b)中的十字线表示射野入射方向。图1(b)中的十字线表示BEV平面。水平线和垂直线分别表示横向平面和矢状(BPV)平面。每个射野角度3.5D MRI 的组图是按横向面(BPV平面)、冠状面(BEV平面)和矢状面(BPV平面)顺序逐帧采集,每个平面50帧,频率为 4.347 Hz。图1中两线的交叉点为成像中心。在图1中三个成像平面可清晰分辨出射野(肿瘤)中心附近的血管,以白色高亮信号区突出显示。
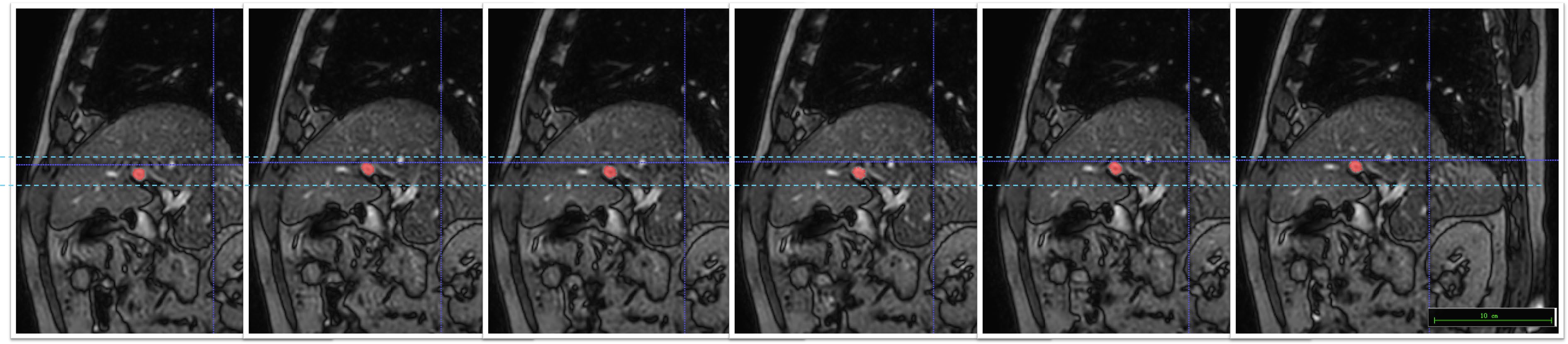
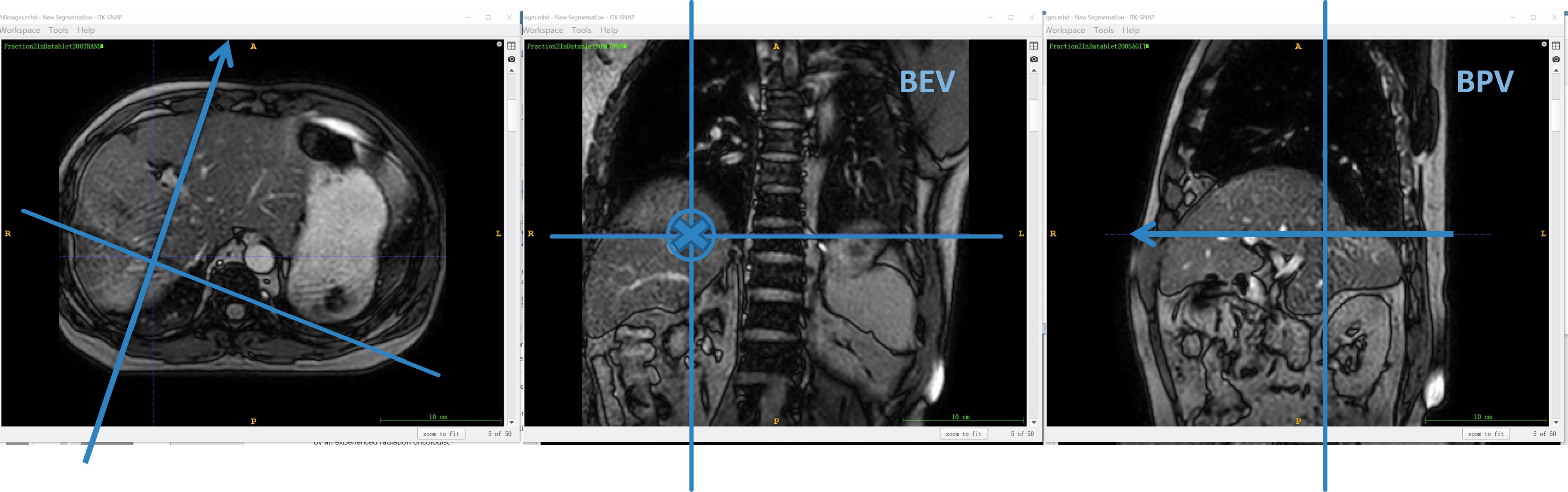
图2展示了患者2的第2个分次治疗的BPV平面成像,红色标注肿瘤附近的血管轮廓,持续6帧成像中的血管运动清晰可见,浅蓝色示意其运动范围,两条深蓝色实线交叉处是射野中心。两帧图像之间的间隔时间为0.69 s,图2覆盖患者2完整的呼吸周期。因此,肿瘤运动幅度的测量可以用附近的血管代替。
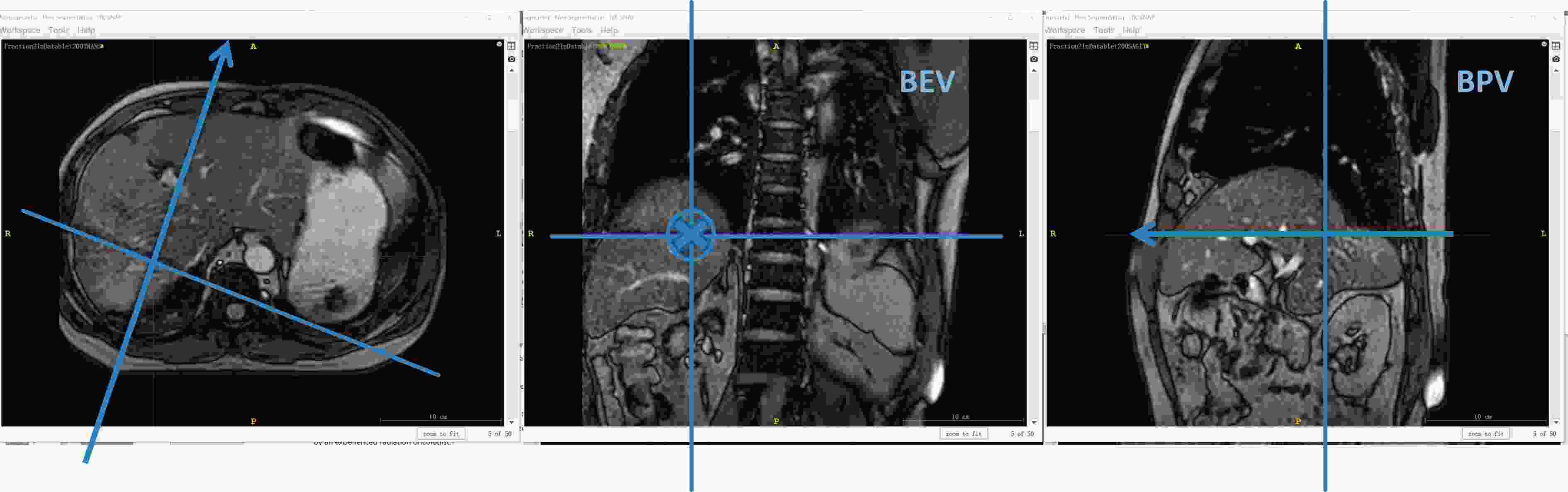
图3展示了FB组与RAM组分别在不同治疗分次中肿瘤附近血管运动的△R95箱线图。3 名患者的 19个分次采集到总共31 200帧MRI成像。如图3(a)所示,患者1第1个分次中RAM组△R95在BEV/BPV平面分别为(6.55±1.74) mm和(6.30±1.78) mm,大于FB组在BEV/BPV平面分别为(4.85±0.48) mm和(4.73±0.90) mm;第2~4分次中RAM组在BEV平面和BPV平面上的△R95均小于FB组;第4个分次中RAM组/FB组在BPV平面的△R95平均值分别为(3.99±0.47) mm/(5.39±0.83) mm。该患者在第1分次中△R95出现RAM高于FB的异常情况,是因为患者在首次采集图像时(第1个分次RAM组)过于紧张呼吸不均匀,从而加大肝部运动幅度,造成RAM高于FB的现象。采取安抚措施后,采集第1个分次FB组和后续治疗分次中没有出现该状况。如图3(b)所示,患者2的BEV平面,RAM组整个治疗分次中的△R95平均值小于FB组;在BEV/BPV平面图像,RAM组的△R95平均值最小值出现在第5分次[(4.64±1.67) mm/(4.80±1.31) mm],在FB组的出现在第8分次[(7.30±1.39) mm/(7.63±0.72) mm];BEV/BPV平面图像,RAM组△R95平均值最大分别来自第9和第1分次[(7.53±1.08) mm/(7.90±1.12) mm)],FB组的来自第2和9分次[(9.90±1.36) mm/(9.72±1.65) mm]。如图3(c)所示,患者3的RAM组BEV/BPV平面图像中同一分次中△R95平均值都小于FB组;△R95平均值中最小为第2分次(6.652±1.280) mm(BEV平面图像的RAM组);△R95平均值中最大出现在第5分次(9.129±0.856) mm(BPV平面图像的FB组)。综上,与FB组相比,所有患者RAM组的靶区运动幅度得到较好控制。
图4展示了BEV/BPV平面上两组血管位置变化的分布情况箱线图。与相应图像平面的FB组相比,BEV/BPV图像平面的RAM组的△R95值较小,差异有统计学意义P<0.05)。在所有分次中三名患者表现出不同的△R95显著性差异(P<0.05):患者1的RAM组和FB组在BEV和BPV图像平面上的△R95中位数差异均小于0.58 mm。患者2的RAM组和FB组在BEV和BPV平面的△R95中位数差异高达约2.57 mm以上。患者3在BEV/BPV成像平面中RAM组和FB组的差异分别为0.71 mm/1.05 mm。由此表明肿瘤运动幅度△R95变化完全是个体化的。因此,对于肝转移SBRT患者而言,MRgRT的安全外放边界需要根据治疗患者进行个性化设置。
Cusumano等[18]报道23名胸腹部肿瘤患者采用自由呼吸门控模式下,采集的4D-CT模拟定位图像和0.35 T磁共振加速器MRIdian上30 s的cine-MR图像,患者前后方向的振幅平均值为(2±1) mm,头脚方向的振幅平均值为(5±3) mm。Rosenberg等[16]报道了多中心采用呼吸门控SBRT临床实践过程,患者需在整个治疗过程中处于屏气状态。Nie等[19]提出通过采集4D-MRI 图像生成的射野二维cine BEV平面图像来监测肿瘤运动。相关研究表明肿瘤运动不可忽视,图像监控至关重要。本研究利用射野特异性的三个正交成像平面,可直观获取肿瘤运动情况,有助于解决图像的不确定性问题。同时,质子治疗的射束投送比光子治疗更容易受到肿瘤体积变化或射束路径上正常组织解剖结构变化的影响[20]。本研究中提出的3.5D MRI方法将可成为解决运动靶区质子治疗的影像方案之一。
-
建立的新型融合BEV/BPV信息的高分辨率快速磁共振成像方法,具有高分辨率、实时、直观显示放疗射野中心层面等特点。通过对于同一患者腹部压迫和自由呼吸两种运动管理模式的肿瘤运动幅度比较验证了该方法的临床适用性。腹部压迫方式对于所有患者都不同程度地有效减少了肿瘤运动幅度,肿瘤位置的变化呈现个体的趋势。该方法也可作为磁共振引导放疗中肿瘤放疗外放边界缩小的影像基础技术。
A Novel High-resolution Fast Magnetic Resonance Imaging Method Incorporating BEV/BPV Fusion Information
doi: 10.11804/NuclPhysRev.41.2023CNPC72
- Received Date: 2023-08-07
- Rev Recd Date: 2023-10-14
-
Key words:
- High-resolution fast magnetic resonance imaging /
- BEV/BPV information fusion /
- amplitude of motion comparison /
- patients with liver metastases /
- magnetic resonance-guided radiotherapy
Abstract: This study establishes a novel high-resolution fast magnetic resonance imaging(MRI) method that incorporates Beam Eye View(BEV) and Beam Path View(BPV) fusion information. Three liver metastasis patients undergoing MRI guided radiotherapy(MRgRT) were selected. A total of 31 200 frames of MRI images were acquired from each patient using two motion patterns: restricted abdominal motion using an abdominal compression belt(RAM group) and free breathing(FB group). Tumor tracking was performed using nearby vessels with clear boundaries, and the radial vector motion amplitude difference(∆R95) within the 95% confidence interval was calculated. The differences in ΔR95 between the RAM and FB groups in all fractions on the BEV/BPV plane were as follows: for Patient 1, they were all less than 0.58 mm; for Patient 2, they were greater than 2.57 mm; for Patient 3, they were 0.71 mm and 1.05 mm, respectively. The results indicate that the abdominal compression technique can effectively reduce tumor motion magnitude, and the tumor motion magnitude ΔR95 variation is highly individual-specific. This method can serve as an imaging basis for the tumor margin reduction in MRgRT.
| Citation: | Jiayun CHEN, Xiaoqi WANG, Shirui QIN, Ran WEI, Deqi CHEN, Ke ZHANG, Ying CAO, Jianrong DAI, yuan TANG. A Novel High-resolution Fast Magnetic Resonance Imaging Method Incorporating BEV/BPV Fusion Information[J]. Nuclear Physics Review. doi: 10.11804/NuclPhysRev.41.2023CNPC72 |




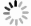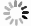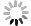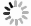



 甘公网安备 62010202000723号
甘公网安备 62010202000723号 DownLoad:
DownLoad: