-
黄芩是唇形科植物(Scutellaria baicalensis Georgi, SBG), 黄芩的干燥根,具有清热燥湿、泻火解毒和安胎等功效。黄芩含有黄酮类、苯丙素类、甾类等多种活性成分,尤其富含黄酮类化合物[1]。黄芩药效成分经常被添加到中成药中,据统计70%的市售中成药中都含有提取自黄芩的药效成分[2]。黄芩作为“三药三方”使用的药材之一[3],近年来在新冠病毒中医药防治中起到了重要作用。在治疗确诊新冠病例的160 余首处方中,黄芩的使用频次位列前十[4]。黄芩的需求量逐年增大,已成为常用大宗药材之一[5]。野生黄芩在我国北方分布广泛,但常年的过度采挖导致野生资源遭到严重破坏[6]。如今,药用黄芩主要来自人工栽培[7],但其栽培时间较短,在种植过程中易受气候环境的影响,品种退化严重[8],导致了黄芩品质良莠不齐,最终影响了药材的质量。
辐射诱变是一种有效的物理诱变育种方法,利用重离子束、γ射线、中子、质子等物理诱变源对生物材料进行辐照,增加了植物基因的突变频率,从而在较短时间筛选到表型变异的突变体[9]。其中,重离子束因其独特的优势而备受关注,它具有高的传能线密度(Linear Energy Transfer, LET)和相对生物学效应(Relative Biological Effectiveness, RBE),在育种中表现出突变率高、突变谱广以及育种周期相对较短等特点[10-13] ,已在作物和观赏植物中取得了较多的研究成果。Okamura等[14]利用重离子束、X射线及γ射线辐射康乃馨,结果发现重离子束辐射的植株产生了更多的花色及花型变异。Hase等[15]发现,相比于γ射线,使用重离子束辐射水稻种子能够获得更高的突变率,更容易获得理想的突变体。在我国,重离子束辐射诱变技术首先应用于农作物育种领域[16],随后在各类植物中有越来越多的应用。如中国科学院近代物理研究所获得了白花紫露草的彩叶突变体[17],Gao[18]探究了重离子辐照对“小凤兰”根状茎和“君红兰”类原球茎存活和分化的影响,并得到了两株变异株。近年来,该技术也逐渐应用于药用植物种质资源创新研究,如应用该技术培育的青蒿科蒿1号[19]、当归岷归3号[20]等中药材新品种。然而,黄芩育种仍旧多采用系统选育法或化学诱变,如获得了晚花黄芩[21]、黄芩同源四倍体D20[22]等,目前未见有重离子束辐射诱变黄芩的报道。
植物经辐射处理后,其生理生化响应过程较为复杂,研究药用植物经辐射处理后的形态学及生理学改变,能够更好地了解药用植物对辐射的响应机制。Li等[23]探究了γ射线辐射对4种品种百合的诱变效应,结果发现,所有品种的超氧化物歧化酶(Superoxide dismutase, SOD)活性均先升高后降低,丙二醛 (Malondialdehyde, MDA)含量均逐渐增强。Wu等[24]利用γ射线辐射姜黄种根,发现60 Gy处理的姜黄VM2世代的姜黄素含量较对照显著提高。 Yang[25]发现,25 Gy剂量的γ射线辐射能提高青花椒幼苗的叶绿素a (Chlorophyll a, Chl a)与叶绿素b (Chlorophyll b, Chl b)含量。但相比于粮食作物及经济作物的育种研究,重离子束诱变育种技术在药用植物领域的应用仍相对薄弱。本研究将用12C6+束辐照黄芩幼苗,探究重离子束辐射对黄芩幼苗在不同时期的生物学效应、生理损伤的影响,并对辐射后黄芩生长发育及生理学进行研究,以期了解重离子束对药用植物的当代辐射生物学效应。
-
黄芩干种子来源于定西市农业科学研究院。2022年4月,将黄芩种子置于铺有去离子水浸湿滤纸的方形培养皿中(10 cm×10 cm),置于恒温光照培养箱(24±1) ºC萌发,光周期:光照16 h加黑暗8 h。萌发9 d后,挑选长势一致的幼苗置于含有湿润滤纸的35 mm圆形培养皿中,室温下进行高能重离子束辐射处理。
-
高能12C6+束流由兰州重离子研究装置(Heavy Ion Research Facility in Lanzhou, HIRFL)的浅层重离子束生物辐射终端(Terminal 4, TR4)提供,初始能量为967 MeV,贯穿样品的平均LET为34 keV·μm−1,剂量率为20 Gy·min−1,辐照剂量分别为5, 10, 20, 30和40 Gy。对照组置于和处理组相同的环境条件中,但不进行辐照处理。
-
辐照后立即将幼苗移栽至50孔穴盘,培养基质为营养土:珍珠岩 = 3:1,在光照培养间中培养,光周期为光照14 h加黑暗10 h,温度为(21±2) ºC。3周后将幼苗转移至方形育苗盆中(9 cm×9 cm),继续培养至9周。
-
对辐照后生长了3周的黄芩幼苗进行存活率统计,长出2对及以上真叶的幼苗记为存活植株。
-
苗高:分别对辐射后生长了3周、6周和9周的黄芩幼苗进行苗高测定,以幼苗子叶基部至幼苗顶端的距离为苗高,每处理组测量10株。
叶片数:分别对辐射后生长了3周、6周和9周的黄芩幼苗进行叶片数测定,每处理组测量10株。
分枝数:对辐射后生长了9周的黄芩幼苗进行分枝数测定,每处理组测量10株。
生物量:分别对辐射后生长了3周、6周和9周的黄芩幼苗的地上和地下部分生物量分别进行测定,并计算根冠比,每处理组测量5株。
-
分别对辐射后生长3周、6周和9周的黄芩幼苗近顶端第二对真叶进行混合取样0.05 g,用乙醇浸提法[26]提取叶绿素。使用酶标仪(Tecan Infinite 200)测定665、649及470 nm波长下的吸光度,根据公式计算叶片单位鲜重的Chl a、Chl b、总叶绿素(Total Chlorophyll, Total Chl)和类胡萝卜素(Carotenoids, Car)含量。计算如下:
$$ {C}_{\rm{Chl}\;{\rm{a}}} = 13.95 \times {{A}}_{\rm{665}} - 6.88 \times {{A}}_{649} \text{,} $$ $$ C_{{\rm{Chl}}{\text{ }}{\rm{b}}} = 24.96 \times {{A}}_{649} - 7.32 \times {{A}}_{665} \text{,} $$ $$ C_{{\rm{Total}}{\text{ }}{\rm{Chl}}} = 6.63 \times {A}_{665} - 18.07 \times A_{649} \text{,} $$ $$ {C}_{\rm{Car}} = \frac{{1\,\,000 \times {{A}}_{470} - 2.05 \times {{C}}_{{\rm{Chl}}{\text{ }}{\rm{a}}} - 114.8 \times {{C}}_{{\rm{Chl}}{\text{ }}{\rm{b}}}}}{{245}} \text{,} $$ $$\omega = \frac{{{{C}} \times {{V}}}}{{{W}}} \times 1\,\,000 \text{,} $$ 式中:C为光合色素浓度(mg/L);A为相应波长下的吸光度;ω为光和色素含量(mg/g);V为提取液体积(L);W为样品鲜重(g)。
-
分别取辐射后生长了3周、6周和9周的黄芩幼苗地上部分叶片,混合取样0.1 g,液氮速冻后置于−80 ºC低温冰箱冷冻保存,用于后续抗氧化酶分析。SOD活性采用氮蓝四唑法[27]测定,过氧化物酶(Peroxidase, POD)活性采用愈创木酚法[28]测定,过氧化氢酶(Catalase, CAT)活性采用过氧化氢分解法[29]测定,MDA含量采用硫代巴比妥酸显色法[29]测定。
-
辐射后的黄芩幼苗培养9周,使用便携式光合作用仪(Yaxin-1102G)测定幼苗叶片的净光合速率 (Net Photosynthetic Rate, Pn),气孔导度(Stomatal Conductance, Gs),蒸腾速率 (Transpiration Rate, Tr)及胞间二氧化碳浓度(Intercellular CO2 Concentration, Ci)。
-
总黄酮提取:辐射后的黄芩幼苗培养9周,取材幼苗地下部分,置于烘箱中60 ºC干燥48 h,用研钵研成粉末。各组取0.1 g样品置于50 mL锥形瓶中,加入25 mL 70%乙醇,超声提取40 min,过滤,滤渣再加入25 mL 70%乙醇,超声40 min,过滤。合并两次滤液,在60 ºC下浓缩干燥。所得干燥粉末用70%乙醇定容至10 mL,待测。
标准曲线制作:配制浓度为 0.416 mg/mL的芦丁标准品95%乙醇溶液。量取 0,0.2,0.4,0.6,0.8和1.0 mL芦丁标准液,分别加入5%的亚硝酸钠水溶液0.3 mL,室温静置6 min;加入10%的硝酸铝水溶液0.3 mL,静置6 min;加入4%氢氧化钠水溶液4 mL,用去离子水定容至10 mL,充分摇匀后静置 3 min,使用酶标仪测定508 nm波长下的吸光度。得到线性回归方程为
$$ {{A}}_{508} = 5.633\,\,9C + 0.042\,\,6({R^2} = 0.998\,\,3) \text{,} $$ $$ \omega = \frac{{C \times V}}{W} \text{,} $$ 式中:A表示吸光度;C表示总黄酮浓度(mg/mL);ω表示总黄酮含量(mg/g);V表示待测液体积(L);W表示样品重量(g)。
-
使用Agilent 5 TC C18色谱柱(4.6 mm×250 mm, 5 μm);流动相:0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱(0~5 min, 32%~35% B; 5~15 min, 35%~50% B),流速1 mL/min;检测波长275 nm;柱温27ºC;进样量10 μL。
-
称取3.94 mg黄芩素对照品(中国食品药品检定研究院,纯度97.9%,批号111595-201808)置于10 mL容量瓶中,加甲醇超声溶解并定容至10 mL。
-
取1.4.6节的待测液1.5 mL,用0.22 μm微孔滤膜过滤,滤液即为供试品溶液。
-
分别精密量取对照品溶液0.4, 0.8, 1.2, 1.6, 2.0 mL置于5个2 mL容量瓶中,加甲醇稀释至2 mL摇匀,0.22 μm微孔滤膜过滤,备用;分别吸取上述不同浓度的溶液各10 μL,按1.4.7.1节色谱条件进样测定。以峰面积积分值(Y)对其质量浓度(X, mg/mL)进行线性回归,得到回归方程为
$$ Y = 5.486 \times {10^7}X + 7.194 \times {10^4}({R^2} = 0.9995) \text{,} $$ 表明黄芩素在0.039~0.386 mg/mL的检测浓度范围内线性关系良好。
-
所有试验均重复3次,所得数据用平均值±标准差表示。差异显著性分析使用SPSS 29软件的单因素方差分析(One-way ANOVA)的Tukey法进行。使用GraphPad Prism 9软件进行单击多靶模型拟合及绘图。
-
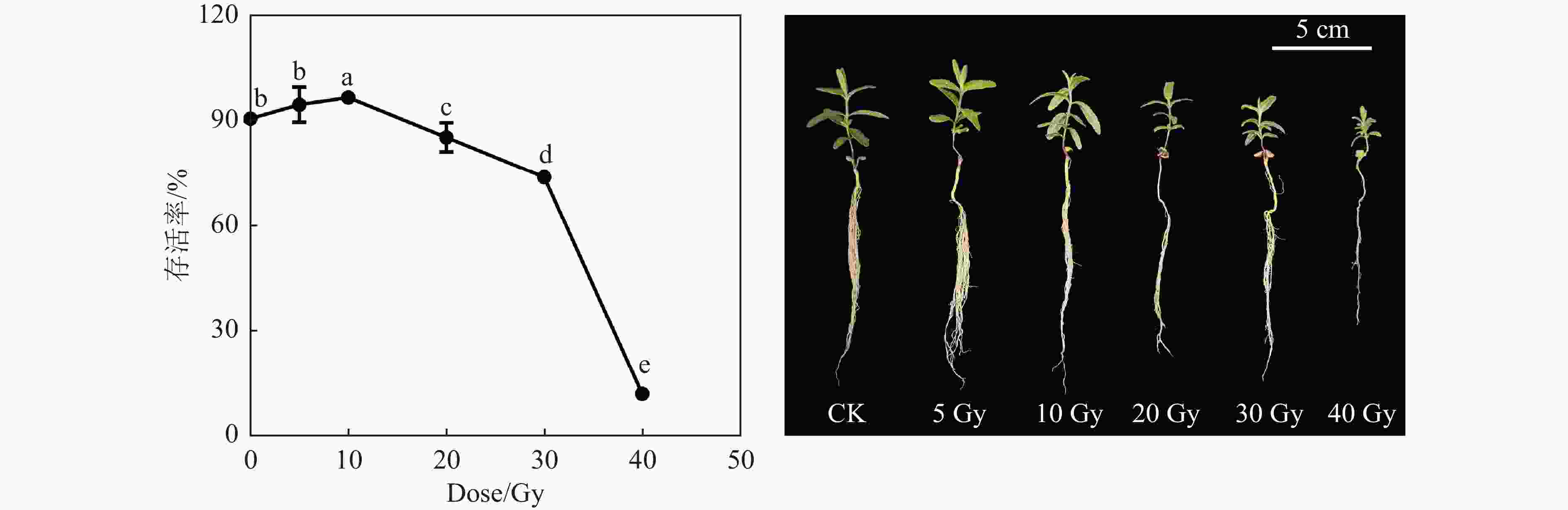
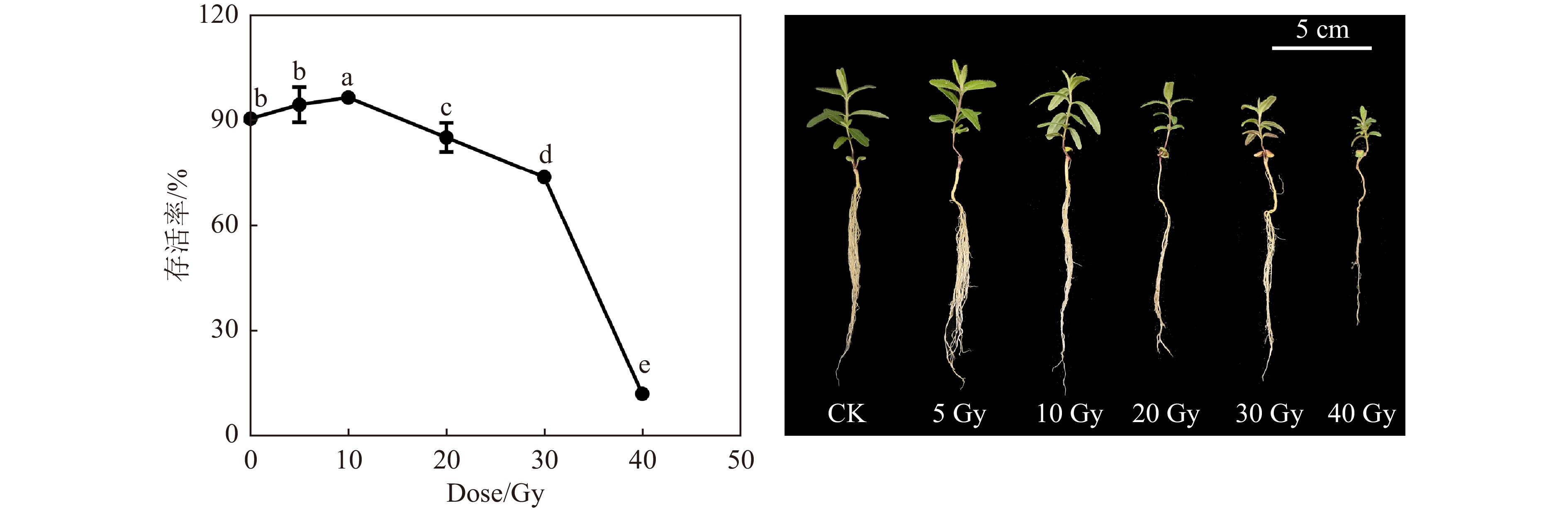
黄芩幼苗经不同剂量的高能碳离子束辐射后,培养3周,其生长受到不同程度的影响。对照组的存活率为90.00%,5 Gy的碳离子束辐射对幼苗的存活率影响不显著(图1),10 Gy辐射后存活率提高至96.67%, 20 Gy辐射后存活率降低至87.33%,40 Gy的存活率仅为12.00%。高于10 Gy的碳离子束辐射抑制了幼苗真叶的发育;当辐照剂量为40 Gy时生长抑制效应最为明显,且存活的植株矮小。根据单击多靶模型
$S = 1 - {\left( {1 - {{\rm {e}}^{-\frac{{D}}{{D_{0}}}}}} \right)^N}$ ,拟合结果为D0 = 4.247,N = 1573,R2 = 0.928。根据拟合结果计算半致死剂量为32.82 Gy。 -
高能碳离子束辐射对黄芩苗高的影响如图2(a)所示。辐射后3周,5 Gy辐射使黄芩苗高降低,10 Gy处理组的苗高与对照组差异不显著,20 和30 Gy辐射抑制了黄芩苗高。辐射后6周,5、10和20 Gy的处理组苗高较对照组分别增加了22.63%、16.57%和16.11%,30 Gy处理组苗高降为对照组的76.98%。辐射后9周,20 和30 Gy处理组苗高降低,分别为对照组的90.59%和57.14%。说明在辐射后较短时期内(3周),除了10 Gy处理组外,苗高受辐射影响而降低;辐射后6周较低剂量(5~20 Gy)刺激了黄芩生长;而辐射后期(9周),较低剂量组的苗高与对照组相当,高剂量抑制了苗高。说明黄芩幼苗经不同剂量的碳离子束辐射处理后,苗高的变化趋势随时间变化不尽相同。总体来说,随辐射后培养时间的延长,较低剂量组的存活植株苗高与对照组苗高接近,高剂量组的苗高仍会受到抑制。
-
高能碳离子束辐射对黄芩的叶片生长及分枝发育造成了影响[图2(b)和(c)]。辐射后3周,20 Gy处理组的叶片数降低。辐射后6周,30 Gy的处理组的叶片数减少。辐射后9周,5 Gy辐射组的叶片数增多, 5和10 Gy处理组的分枝数增加,而30 Gy处理组的分枝数减少,仅为对照组的42.86% [图2(c)]。总体来看,10 Gy辐射后的黄芩幼苗有较多的叶片数和分枝数。
-
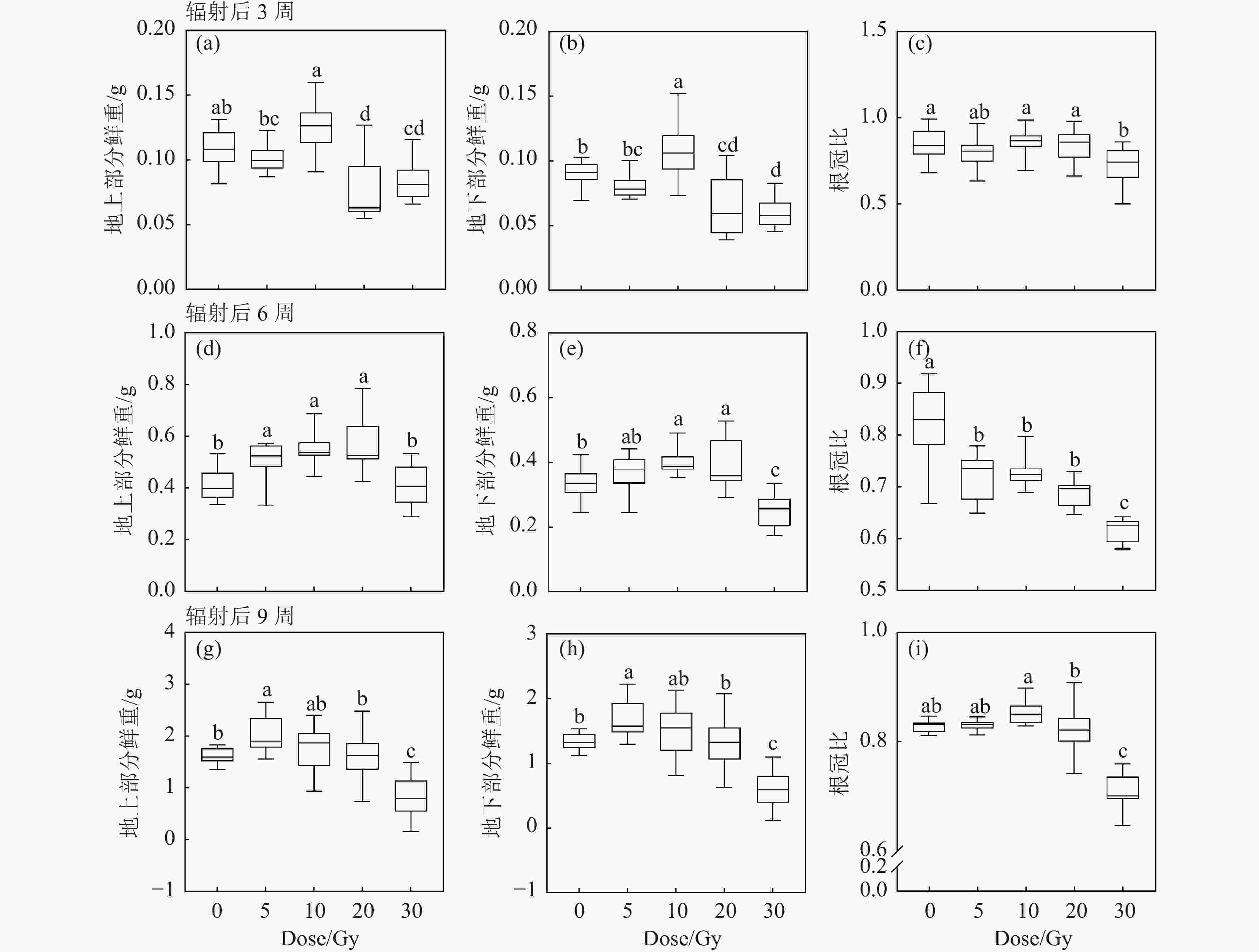
重离子束辐射对黄芩幼苗地上部鲜重、地下部鲜重和根冠比的变化规律与照射后培养时间相关(图3)。辐射后3周,20和30 Gy辐射后地上部分和地下部分鲜重降低;10 Gy辐射刺激了黄芩生物量的增加;5, 10和20 Gy处理组的根冠比较对照组无显著性差异,30 Gy处理组的根冠比较对照组降低[图3(a)~(c)]。辐射后6周,5~20 Gy辐射后的地上部分和地下部分鲜重增加,进一步说明低剂量辐射刺激了生物量积累[图3(d)和(e)]。辐射后9周,5 Gy辐射增加黄芩生物量,而30 Gy辐射抑制了黄芩生长;剂量小于20 Gy的根冠比较对照组无显著差异,30 Gy组的根冠比大幅降低[图3(g)~(i)]。结果表明,5和10 Gy的低剂量辐射具有刺激植物生物量积累的效果。
-
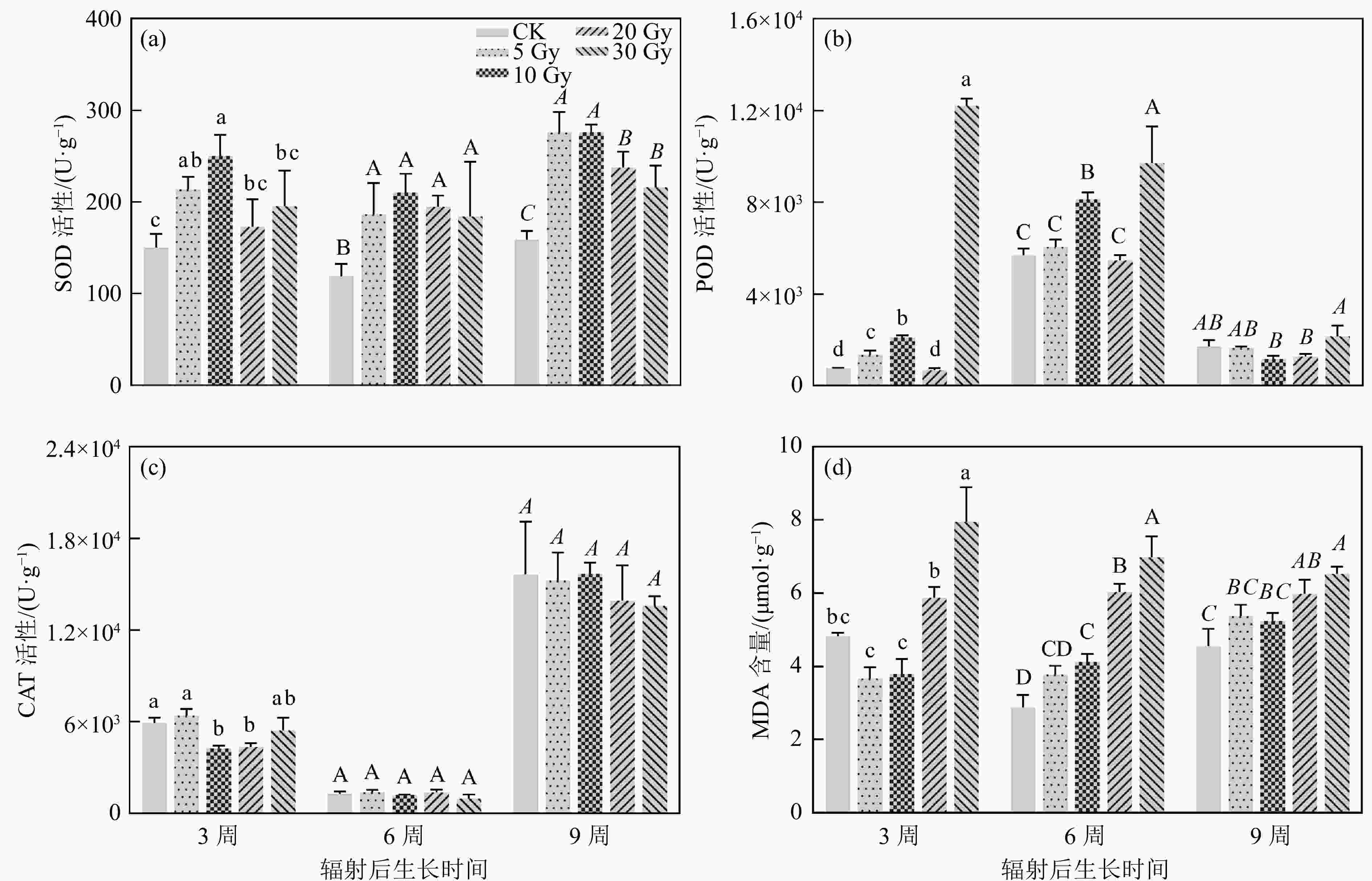
辐射导致植物体内活性氧(Reactive Oxygen Species, ROS)积累,植物激活抗氧化酶系统以清除ROS。本研究发现,辐射后3周、6周和9周,SOD活性随剂量先升高后降低,且10 Gy处理组的SOD活性最高[图4(a)]。POD的活性在辐射后3周及6周幼苗中呈现出随剂量先升高后降低又升高的趋势,辐射后9周幼苗POD的活性随剂量先降低后升高。且在相同时间内,30 Gy处理组的POD活性最高;辐射后6周的POD活性均比辐射后3周及9周高[图4(b)]。在同一时期内,幼苗CAT的活性仅在辐射后3周呈现出随剂量先降低后升高的趋势,而辐射后6周及9周并无显著差异。且在辐射后6周,幼苗POD的活性均比辐射后3周及9周低[图4(b)]。MDA含量高低反映了细胞膜损伤的程度,在辐射后3周、6周和9周,5和10 Gy处理组的MDA含量与对照组的差异不大[图4(d)],而20和30 Gy的MDA含量显著升高,说明高剂量对黄芩幼苗细胞膜造成了严重的损伤,且在短时间内不易恢复。
-
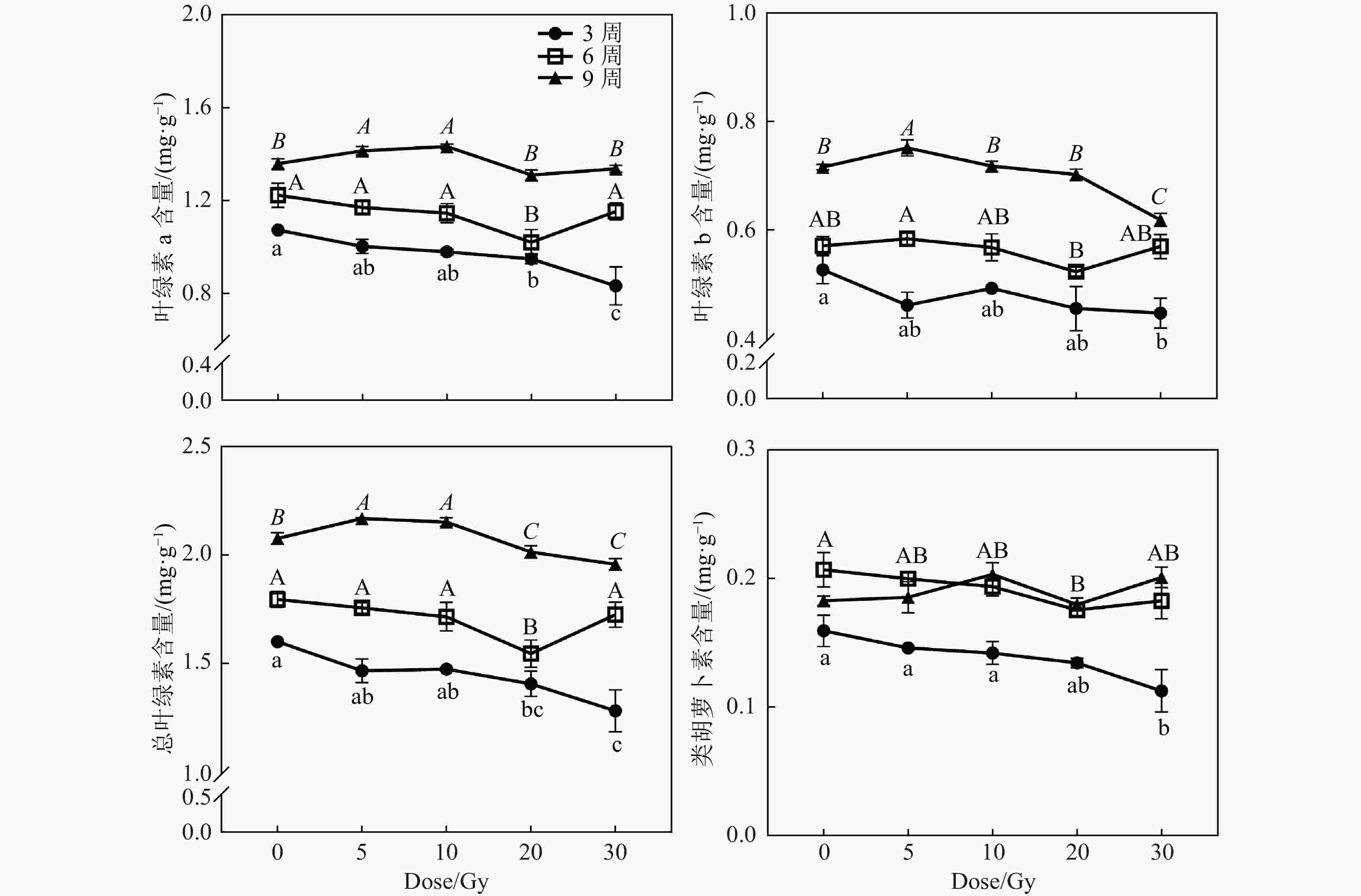
光合色素含量在辐射后3周和6周,随着辐射剂量的升高而降低,辐射后9周与对照组差异不显著(图5)。辐射后3周,仅20和30 Gy组的Chl a、Chl b及Total Chl含量较对照组降低,而较低剂量辐射组与对照组差异不显著。辐射后6周,仅20 Gy组的Chl a和Total Chl含量较对照组降低。辐射后9周,5和10 Gy处理组的Chl a和Total Chl含量较对照组升高,而20和30 Gy处理组的叶绿素含量显著下降。这说明较低剂量辐射后的黄芩幼苗的叶绿素含量在辐射后期甚至能超过对照组。而类胡萝卜素在辐射后3周和6周,分别在20和30 Gy处理组较对照组降低,说明20和30 Gy剂量的碳离子束辐射在辐射前期抑制了幼苗类胡萝卜素的积累。但在辐射后期(9周),各处理组的类胡萝卜素含量无显著差异,说明这种抑制现象会随着时间而恢复。
-
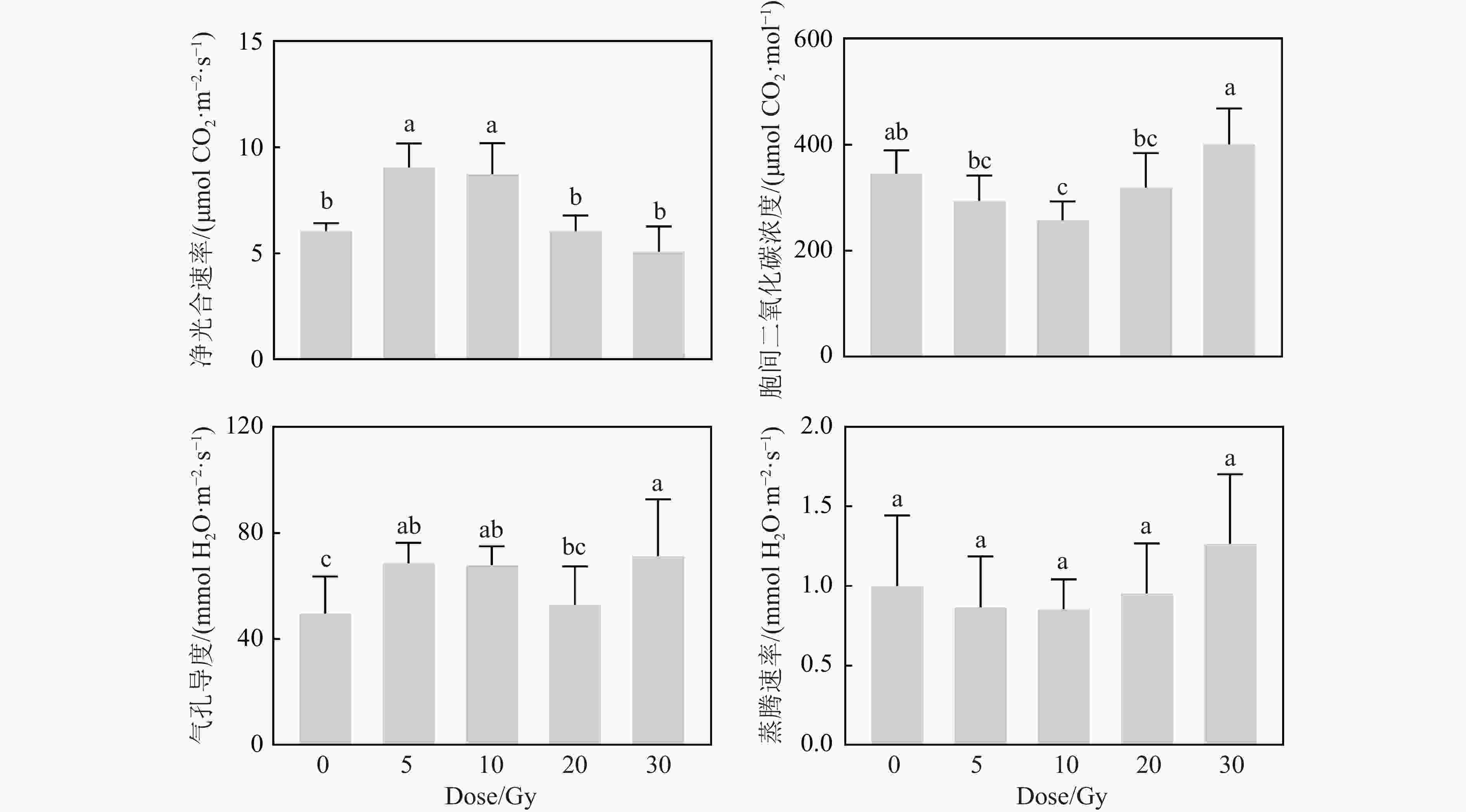
碳离子束辐射后,黄芩幼苗叶片的光合作用参数受到影响(图6)。5和10 Gy处理组的净光合速率(Net Photosynthesis Rate, Pn)较对照组显著升高,分别提高了49.89%和44.63%。20和30 Gy处理组的Pn与对照组没有显著差异。5和10 Gy处理组的气孔导度(Stomatal Conductance, Gs)也较对照组显著升高,分别增加了38.31%和36.84%,20 Gy辐射后的Gs与对照组相当,但30 Gy组较对照组显著升高。胞间二氧化碳浓度(Intercellular CO2 Concentration, Ci)随着剂量先降低后升高。但蒸腾速率(Transpiration Rate, Tr)在各处理组间没有显著性差异。总体上,低剂量(5和10 Gy)辐射增强了黄芩的净光合速率和气孔导度。
-
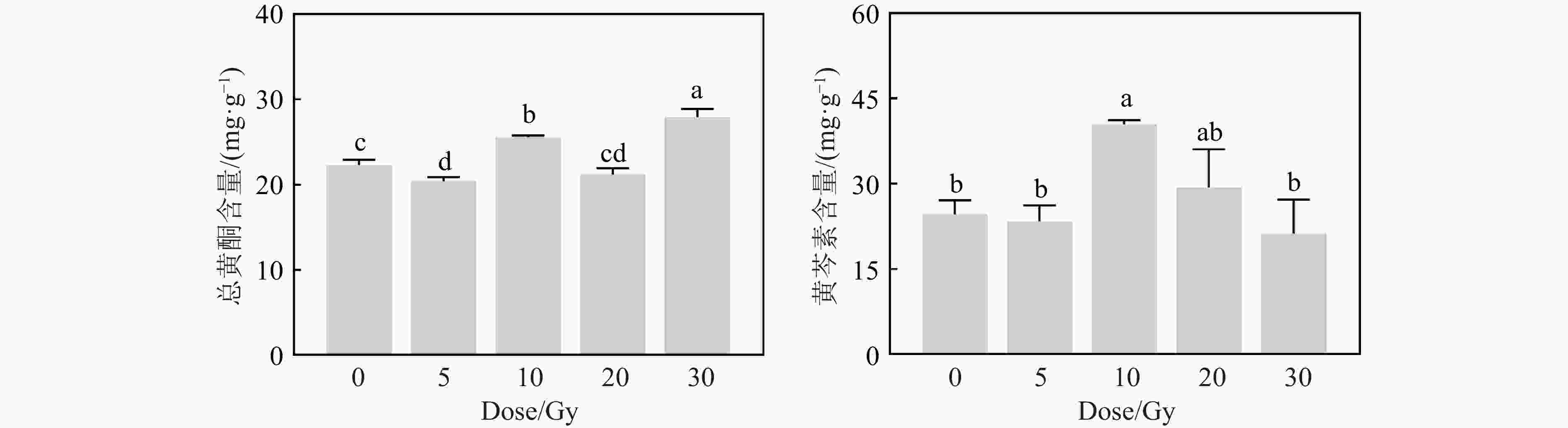
高能重离子束辐射不仅影响了黄芩的生长发育,也影响了次生代谢产物的积累。5 Gy辐射后黄芩根部总黄酮含量降低了8.55%;10 Gy处理组的总黄酮含量升高了14.69%;30 Gy处理组的总黄酮含量较对照组显著提高,这主要是因为高剂量辐射后根的生长被抑制,所以单位重量的次生代谢产物增加。此外,10 Gy处理组的黄芩素含量也较对照组显著升高了64.22%,其余剂量的辐射处理组均与对照组无显著差异。说明10 Gy的重离子辐射有效地增加了黄芩根中药用成分的积累。
-
辐射剂量的选择对植物辐射育种至关重要,选择适宜的辐射剂量是获得理想突变体的技术前提[30]。多数学者认为适宜的辐射剂量为半致死剂量(semi-lethal dose, LD50)[31],在该剂量辐射下,植物能在较高存活率下产生更多的突变[31]。本研究的LD50是依据“单击多靶”模型拟合获得,该模型是“多靶多击”模型的简化,是基于辐射击中理论和靶学说发展起来的一种描述辐射生物学效应的数学模型。其中心思想为:生物体细胞内存在多个敏感的靶,当生物体受到辐照时,这些靶点被辐射粒子击中且必须全部失活才能导致细胞死亡,假设这些靶点只需一次击中便可失活,即为“单击多靶”[32]。目前此模型已应用于各类植物的辐射效应研究中,尤其是具有高LET的重离子束辐射育种工作[33-35]。黄芩幼苗的高能碳离子束辐射LD50为32.82 Gy [图1(a)],但接近半致死剂量的重离子束辐射(30 Gy)后的黄芩表现为生长抑制,是否为最佳的诱变育种剂量还需要进一步的研究。另外,黄芩幼苗的LD50远远低于黄芩种子的LD50(约为170 Gy),说明幼苗比种子的辐射敏感性更强。这可能是种子处于休眠状态,生理活动基本停滞,而幼苗的含水量较高,细胞有活跃的生理活动,DNA和蛋白质等生物大分子更易受到辐射的影响[36]。我们研究发现,10 Gy重离子束辐射后黄芩的存活率提高(图1)、长势好(图2)、生物量高(图3)、较高的酶活能有效清除ROS(图4)、叶绿素含量高(图5)、光合速率高(图6),并且根中积累了较多的药用成分(图7),所以10 Gy的重离子束辐射具有促进黄芩生长和次生代谢产物积累的作用,但可否作为黄芩幼苗适宜的高能碳离子束诱变剂量,尚需对其育性及后代变异进行考察。
植物经历辐射后,在当代往往会表现为生长发育受到影响。本研究中,黄芩幼苗辐照后的苗高和叶片数均随剂量先升高后降低[图2(a)和(b)],这与Qian等[37]的研究一致。辐射后9周,幼苗的分枝数随剂量先升高后降低[图2(c)],这与Wang等[38]和Zhang等[39]的发现相似,说明在低剂量下,碳离子束辐射能刺激黄芩幼苗分枝数的产生。同时,5和10 Gy的碳离子束辐射,既促进了黄芩地上部分的生长,也促进了黄芩根的生长(图3)。林仙淋[40]探究了γ辐射对多花野牡丹幼苗生长的影响,发现幼苗的鲜重随剂量的增加呈现先升高后降低的趋势。Wang等[41]发现低于100 Gy剂量的γ辐射能够促进野牛草幼苗茎叶和根系发育。根冠比是衡量地下部分与地上部分是否协调的一个重要指标,根冠比高,根系机能活性强,反之则根系机能活性弱[42]。Lu等[43]探究了碳离子束辐照菘蓝干种子的当代效应,发现6个月菘蓝的根冠比均较对照组显著降低;Liao等[44]采用不同剂量γ射线辐照刺梨幼苗,结果发现刺梨幼苗的根冠比随剂量升高而降低。我们的研究也表明较高剂量的重离子束辐射导致了根冠比下降(图3)。
当植物受到辐射时,首先会产生直接的辐射损伤,如生物大分子的损伤,辐射的能量直接沉积于生物大分子,造成DNA链的断裂、蛋白酶失活或者破坏细胞膜的结构或通透性,从而影响细胞的正常功能。其次是植物体内的水经过辐射后,产生的ROS对植物造成较为长期的影响[45]。而植物体内的抗氧化酶系统可以清除ROS、自由基从而缓解这种损伤[46]。其中,SOD可以消除超氧自由基对细胞膜的损伤[47],POD可以通过降解植物体细胞中的H2O2来避免对细胞的损伤,CAT可以通过促进H2O2的分解来减少H2O2对细胞的损伤[48]。辐射后6周至9周,幼苗抗氧化酶系统皆出现了改变(图4),其中各辐射处理组的SOD活性都较对照组显著增强;对照组和各辐射处理组的POD活性在辐射后6周出现峰值,在辐射后9周降低;CAT活性在辐射后6周最低,而在辐射后9周最高。说明幼苗在短中期的生长过程中,各抗氧化酶协同清除ROS,从而达到动态的平衡[49]。MDA是膜脂过氧化的终产物之一,其含量高低可以反映机体内脂质过氧化的程度,间接反映出细胞损伤的程度。前人研究表明[50],植物在受到辐射后,其体内MDA含量随剂量升高而升高。在本研究中,幼苗MDA含量在辐射后6周和9周均呈现出随剂量升高的趋势,且20和30 Gy处理组的MDA含量处在较高水平,说明在这两个剂量下,幼苗受到的间接损伤更为严重。而在辐射后3周,幼苗的MDA含量随剂量先降低后升高,这可能和幼苗体内的SOD活性较高有关。
研究表明,植物的抗氧化酶活性与叶绿素含量呈现正相关[51]。叶绿素是参与光合作用的主要色素,在一定程度上反映了光合作用的水平,其生物合成受到多种因素的影响[52]。Li[53]发现一定剂量的碳离子束辐射可不同程度增加燕麦的叶绿素含量。本研究中,叶片中叶绿素含量先呈现出随剂量升高而降低的趋势,后随着植株的生长最终表现出先升高后降低的趋势(图5),说明低于10 Gy剂量的辐射在一定时间内能促进黄芩幼苗的叶绿素积累,从而增强光合作用。类胡萝卜素作为叶绿素的保护色素,同时也是非酶促抗氧化剂,能在一定程度上起到清除自由基的作用。本研究中,20 和30 Gy处理组的类胡萝卜素含量在辐射前期较对照组显著降低,说明高剂量碳离子束的辐射破坏了幼苗的非酶促抗氧化系统,也因此影响到了叶绿素的合成。另有研究发现,抗氧化酶活性的升高可以参与稳定光合作用机构的功能,在一定程度上提升光合速率[54-55]。黄芩幼苗在辐射后9周的光合作用参数结果(图6)显示,Pn呈现先升高后降低的趋势,这与Zhu等[56]的研究一致,说明在一定剂量下,碳离子束辐射能促进幼苗的光合能力;同时该趋势与苗高的情况保持一致,说明在低剂量辐射下,辐射不仅会引起损伤,还会在一定程度上刺激植物的生长,这与Liu等[57]的研究结果一致。Gs表明气孔的开闭程度,对植株的光合作用具有很重要的影响[58],在自然状态下,其日变化与Tr日变化关系密切。本研究中Gs和Tr之间并不一一对应,这可能是由于幼苗生长在较为均衡的环境中导致的,此时,与Gs密切相关的是Pn,Pn越大,所需的CO2的量也就越大,Gs随之增加,而相应的Ci也会减小。但30 Gy处理组的Gs却随着Pn减小而增大,这可能是由于在相对较高的剂量下,辐射直接或间接损伤了幼苗叶片气孔的调控机制,从而导致气孔无法像正常植株一样开闭。
黄酮类化合物是植物在长期的生态适应过程中为抵御恶劣生态条件、动物、微生物等攻击而形成的一大类次生代谢产物[59],不仅能调节根生长和养分吸收[60],同时通过清除自由基及抗氧化、保护细胞中遗传物质等方式进行辐射防护[61]。黄芩素是黄芩主要的黄酮类成分之一,具有广泛的药理作用,如抗氧化[62]、抗炎[63]、抗病毒[64]及抗癌[65]等,最新研究发现,黄芩素具有抑制奥密克戎毒株核酸复制的作用[66]。因此,获得黄酮和黄芩素含量高的黄芩品种,是现代药用植物育种的理想目标[67]。Su[68]发现,20~300 Gy的γ射线辐照可显著提高穿心莲地上部分的穿心莲内酯及脱水穿心莲内酯的含量。Yan等[69]发现,30 Gy重离子束处理菘蓝种子,其根中的喹唑酮和靛玉红的含量分别为野生型的2.2倍和2.3倍。本研究中,10 Gy重离子束辐射后,幼苗的总黄酮和黄芩素含量都较对照组显著升高,说明较低剂量的重离子束辐射具有提升黄芩药用成分的潜力。
-
重离子束辐射对黄芩幼苗所造成的生物学效应是一个复杂的过程。本研究中,经不同剂量辐射处理后,幼苗的LD50为32.82 Gy,其苗高、叶片数、分枝数、生物量、根冠比、抗氧化酶活性、光合作用等方面在不同时期对辐射的响应不同。苗高、叶片数、分枝数和生物量等经5和10 Gy低剂量的重离子束辐射后较对照组有显著增加,而经30 Gy辐射后显著下降。辐射后3~6周,叶片中叶绿素含量随剂量呈下降趋势;辐射后9周,低剂量辐射后的总叶绿素含量升高,此时的净光合速率和气孔导度也显著提高。此外,10 Gy的重离子束辐射促进了黄芩根中总黄酮和黄芩素的积累。因此,10 Gy的重离子束辐射,不仅促进了黄芩的生长,还提高了黄芩药用成分的含量,为后续开展黄芩的辐射刺激效应及辐射育种研究提供了基础依据。
Biological Effects of High-Energy Carbon Ion Beam Irradiation on Seedlings of Scutellaria baicalensis
-
摘要: 为探究高能重离子束辐射对黄芩幼苗生理特性及生长发育的影响,采用总能量为967 MeV的碳离子束辐射黄芩幼苗,测定了不同剂量辐射后的存活率、苗高、叶片数、分枝数、生物量、根冠比、抗氧化酶活性、光合作用特性及次生代谢产物的含量。结果显示,与对照组比较,黄芩幼苗的半致死剂量为32.82 Gy。5和10 Gy的重离子束辐射后黄芩的苗高、叶片数、分枝数和生物量均有增加,而30 Gy辐射均为降低。各处理组超氧化物歧化酶(Superoxide dismutase, SOD)和过氧化物酶(Peroxidase, POD)活性增加以减轻辐射造成的活性氧损伤。辐照后6周内,叶片中叶绿素含量随剂量呈下降趋势。辐照后第9周,5和10 Gy辐照提高了叶片的总叶绿素含量、净光合速率和气孔导度,10 Gy辐射促进了黄芩根中总黄酮和黄芩素的积累。研究发现,10 Gy的重离子束辐射促进了黄芩幼苗的生长,并且提高了其药用成分含量。本工作探究了重离子束辐射黄芩的当代生物学效应,为后续开展黄芩的辐射刺激效应及辐射育种研究提供了基础依据。Abstract: To explore the effects of high-energy heavy ion beams irradiation on the physiological and growth characteristics of Scutellaria baicalensis Georgi seedlings, different doses of carbon ion beam with total energy of 967 MeV were selected to irradiate seedlings to measure the survival rate, seedling height, number of leaves, number of branches, biomass, root-shoot ratio, antioxidant enzyme activity, photosynthetic characteristics and content of secondary metabolites. The results showed that the semi-lethal dose of seedlings was 32.82 Gy. The seedling height, number of leaves, number of branches, and biomass of Scutellaria baicalensis increased under 5 and 10 Gy, but decreased under 30 Gy compared with the control group. The activities of superoxide dismutase (SOD) and peroxidase (POD) in all treatment groups increased to reduce the damage of reactive oxygen species caused by irradiation. The content of chlorophyll in leaves decreased with the dose within 6 weeks after irradiation; the content of total chlorophyll, net photosynthetic rate and stomatal conductance of leaves increased under 5 and 10 Gy in 9 weeks after irradiation. In addition, the accumulation of total flavonoids and baicalein in the root were promoted under 10 Gy. These results indicated that 10 Gy heavy ion beams not only stimulated the growth, but also increased the content of medicinal ingredients in Scutellaria baicalensis. The study explored the contemporary biological effects of heavy ion beams radiation on Scutellaria baicalensis Georgi, which provides a basis for the follow-up research on irradiation stimulation effects and radiation breeding of Scutellaria baicalensis Georgi.
-
Key words:
- Scutellaria baicalensis /
- carbon ion beam /
- irradiation /
- biological effect /
- antioxidant enzymes
-
[1] 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China Pharmaceutical Science and Technology Press, 2020. (in Chinese) [2] 张琳琳. 黄芩属药用植物资源适宜性评价及基因组大小测定[D]. 西安: 陕西师范大学, 2014: 5. ZHANG Linlin. Suitability Evaluation and Genome Size Determination of Medicinal Plant Resources of Scutellaria Medicinal Plants[D]. Xi’an: Shaanxi Normal University, 2014: 5. (in Chinese) [3] 郭程程, 焦华琛, 李运伦. 辽宁中医药大学学报, 2020, 22(10): 159. doi: 10.13194/j.issn.1673-842x.2020.10.038 GUO Chengcheng, JIAO Huachen, LI Yunlun. Journal of Liaoning University of Traditional Chinese Medicine, 2020, 22(10): 159. (in Chinese) doi: 10.13194/j.issn.1673-842x.2020.10.038 [4] 赵文翰, 奚小土, 林琳. 海南医学院学报, 2020, 26(19): 1455. doi: 10.13210/j.cnki.jhmu.20200708.002 ZHAO Wenhan, XI Xiaotu, LIN Lin. Journal of Hainan Medical University, 2020, 26(19): 1455. (in Chinese) doi: 10.13210/j.cnki.jhmu.20200708.002 [5] 崔璐, 路俊仙, 林慧彬, 等. 时珍国医国药, 2009, 20(09): 2279. doi: 10.3969/j.issn.1008-0805.2009.09.085 CUI Lu, LU Junxian, LIN Huibin, et al. Lishizhen Medicine and Materia Medica Research, 2009, 20(09): 2279. (in Chinese) doi: 10.3969/j.issn.1008-0805.2009.09.085 [6] 李欣, 黄璐琦, 邵爱娟, 等. 黄芩种质资源的研究概况[C]//全国中药研究学术讨论会论文集, 南昌, 2003: 23. LI Xin, HUANG Luqi, SHAO Aijuan, et al. A Survey of Studies on Scutellaria baicalensis Germplasm Resources[C]//Proceedings of the National Symposium on Traditional Chinese Medicine, Nanchang, 2003: 23. (in Chinese). [7] 杨全, 白音, 陈千良, 等. 时珍国医国药, 2006(7): 1159. doi: 10.3969/j.issn.1008-0805.2006.07.166 YANG Quan, BAI Yin, CHEN Qianliang, et al. Lishizhen Medicine and Materia Medica Research, 2006(7): 1159. (in Chinese) doi: 10.3969/j.issn.1008-0805.2006.07.166 [8] 刘淼, 李西文, 张元科, 等. 世界中医药, 2018, 13(12): 2969. doi: 10.3969/j.issn.1673-7202.2018.12.005 LIU Miao, LI Xiwen, ZHANG Yuanke, et al. World Chinese Medicine, 2018, 13(12): 2969. (in Chinese) doi: 10.3969/j.issn.1673-7202.2018.12.005 [9] 杨兆民, 张璐. 基因组学与应用生物学, 2011, 30(1): 87. doi: 10.3969/gab.030.000087 YANG Zhaomin, ZHANG Lu. Genomics and Applied Biology, 2011, 30(1): 87. (in Chinese) doi: 10.3969/gab.030.000087 [10] 刘瑞媛, 王朴, 李文建, 等. 原子核物理评论, 2014, 31(1): 106. doi: 10.11804/NuclPhysRev.31.01.106 LIU Ruiyuan, WANG Pu, LI Wenjian, et al. Nuclear Physics Review, 2014, 31(1): 106. (in Chinese) doi: 10.11804/NuclPhysRev.31.01.106 [11] YAMAGUCHI H, SHIMIZU A, HASE Y, et al. Breeding Science, 2010, 60(4): 398. doi: 10.1270/jsbbs.60.398 [12] LI Y Q, GU J Y, IRSHAD A, et al. Frontiers in Genetics, 2022, 13: 1. doi: 10.3389/fgene.2022.942806 [13] CABANOS C S, KATAYAMA H, URABE H, et al. Molecular Breeding, 2012, 30(2): 1037. doi: 10.1007/s11032-011-9687-2 [14] OKAMURA M, YASUNO N, OHTSUKA M, et al. Nucl Instr and Meth B, 2003, 206: 574. doi: 10.1016/S0168-583X(03)00835-8 [15] YAMAGUCHI H, HASE Y, TANAKA A, et al. Breeding Science, 2009, 59(2): 169. doi: 10.1270/jsbbs.59.169 [16] 余增亮, 何建军, 邓建国, 等. 安徽农业科学, 1989, 01: 12. doi: 10.13989/j.cnki.0517-6611.1989.01.003 YU Zengliang, HE Jianjun, DENG Jianguo, et al. Journal of Anhui Agricultural Sciences, 1989, 01: 12. (in Chinese) doi: 10.13989/j.cnki.0517-6611.1989.01.003 [17] 刘瑞媛, 余丽霞, 杜艳, 等. 辐射研究与辐射工艺学报, 2015, 33(4): 50. LIU Ruiyuan, YU Lixia, DU Yan, et al. Journal of Radiation Research and Radiation Processing, 2015, 33(4): 50. (in Chinese) [18] 高祥云. 重离子辐照对杂交兰的组培和诱变效应[D]. 广州: 华南农业大学, 2018. GAO Xiangyun. Effects of Heavy Ion Irradiation on Tissue Culture and Mutagenesis in Hybrid Cymbidium[D]. Guangzhou: South China Agricultural University, 2018. (in Chinese). [19] 梁妍, 周翔, 郭建钊, 等. 中国中药杂志, 2019, 44(24): 5363. doi: 10.19540/j.cnki.cjcmm.20191009.107 LIANG Yan, ZHOU Xiang, GUO Jianzhao, et al. China Journal of Chinese Materia Medica, 2019, 44(24): 5363. (in Chinese) doi: 10.19540/j.cnki.cjcmm.20191009.107 [20] 佚名. 大众科技, 2009(7): 2. Anon. Popular Science & Technology, 2009(7): 2. (in Chinese) [21] 温学森. 黄芩新品种——“晚花黄芩”选育成功[C]//全国第二届中药资源生态学学术研讨会论文集, 淄博, 2006: 87. WEN Xuesen. A New Variety of Scutellaria baicalensis Georgi -- "Late Flower Scutellaria baicalensis Georgi" has been Successfully Selected[C]//Proceedings of the Second National Symposium on the Ecology of Traditional Chinese Medicine Resources, Zibo, 2006: 87.(in Chinese) [22] 陈柏君, 高山林, 卞云云. 植物资源与环境学报, 2000(1): 10. CHEN Baijun, GAO Shanlin, BIAN Yunyun. Journal of Plant Resources and Environment, 2000(1): 10. (in Chinese) [23] 李丽辉, 胡瑶, 雷星宇, 等. 核农学报, 2021, 35(8): 1725. doi: 10.11869/j.issn.100-8551.2021.08.1725 LI Lihui, HU Yao, LEI Xingyu, et al. Journal of Nuclear Agricultural Sciences, 2021, 35(8): 1725. (in Chinese) doi: 10.11869/j.issn.100-8551.2021.08.1725 [24] 吴萍, 郭俊霞, 王晓宇, 等. 核农学报, 2021, 35(1): 1. doi: 10.11869/j.issn.100-8551.2021.01.0001 WU Ping, GUO Junxia, WANG Xiaoyu, et al. Journal of Nuclear Agricultural Sciences, 2021, 35(1): 1. (in Chinese) doi: 10.11869/j.issn.100-8551.2021.01.0001 [25] 杨柳璐. 60Co-γ对青花椒幼苗诱变效应的研究[D]. 成都: 四川农业大学, 2019. YANG Liulu. The Studies on Irradiation Effects of 60Co-γ Ray on Zanthoxylum schinifolium Seedlings[D]. Chengdu: Sichuan Agricultural University, 2019. (in Chinese) [26] 屈成, 刘芬, 陈光辉, 等. 核农学报, 2020, 34(9): 2095. QU Cheng, LIU Fen, CHEN Guanghui, et al. Journal of Nuclear Agricultural Sciences, 2020, 34(9): 2095. (in Chinese) [27] GIANNOPOLITIS CN, RIES SK. Plant Physiology, 1977, 59(2): 309. doi: 10.1104/pp.59.2.309 [28] ASGHAR T, JAMIL Y, IQBAL M, et al. Journal of Photochemistry and Photobiology B-Biology, 2016, 165: 283. doi: 10.1016/j.jphotobiol.2016.10.022 [29] DHINDSA R S, PLUMBDHINDSA P, THORPE T A. Journal of Experimental Botany, 1981, 32(126): 93. doi: 10.1093/jxb/32.1.93 [30] 胡瑶, 张跃龙, 李宏告, 等. 核农学报, 2020, 34(3): 453. doi: 10.11869/j.issn.100-8551.2020.03.0453 HU Yao, ZHANG Yuelong, LI Honggao, et al. Journal of Nuclear Agricultural Sciences, 2020, 34(3): 453. (in Chinese) doi: 10.11869/j.issn.100-8551.2020.03.0453 [31] 李秀芬, 张德顺, 吴福兰, 等. 核农学报, 2009, 23(3): 450. LI Xiufen, ZHANG Deshun, WU Fulan, et al. Journal of Nuclear Agricultural Sciences, 2009, 23(3): 450. (in Chinese) [32] KIEFER J. Biological Radiation Effects[M]. Berlin: Springer, 1990: 264. [33] SHIKAZONO N, TANAKA A, KITAYAMA S, et al. Radiation and Environmental Biophysics, 2002, 41(2): 159. doi: 10.1007/s00411-002-0157-4 [34] ZHENG Y C, LI S, HUANG J Z, et al. Plants-Basel, 2020, 9(5): 201. [35] YOKOTA Y, HASE Y, SHIKAZONO N, et al. International Journal of Radiation Biology, 2003, 79(8): 681. doi: 10.1080/09553000310001622832 [36] 石新杰. 60Co-γ辐射及秋水仙素诱导梨突变体的研究[D]. 南京: 南京农业大学, 2019. SHI Xinjie. Study on Pear Mutation Induced with 60Co-γ Radiation and Colchicine[D]. Nanjing: Nanjing Agricultural University, 2019. (in Chinese) [37] 钱平平, 侯岁稳, 吴大利, 等. 辐射研究与辐射工艺学报, 2007(4): 211. doi: 10.3969/j.issn.1000-3436.2007.04.004 QIAN Pingping, HOU Suiwen, WU Dali, et al. Journal of Radiation Research and Radiation Processing, 2007(4): 211. (in Chinese) doi: 10.3969/j.issn.1000-3436.2007.04.004 [38] 王雪. 碳离子束辐照大豆的诱变效应[D]. 吉林: 中国科学院大学(中国科学院东北地理与农业生态研究所), 2021. WANG Xue. Mutation Effects of Carbon Ion Beam Irradiation in Soybean[D]. Jilin: University of Chinese Academy of Sciences (Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences), 2021. (in Chinese) [39] 武振华, 张红, 王新宇, 等. 原子核物理评论, 2010, 27(03): 335. doi: 10.11804/NuclPhysRev.27.03.335 WU Zhenhua, ZHANG Hong, WANG Xinyu, et al. Nuclear Physics Review, 2010, 27(03): 335. (in Chinese) doi: 10.11804/NuclPhysRev.27.03.335 [40] 林仙淋. 60Co-γ辐射对多花野牡丹幼苗生长发育的影响[D]. 福州: 福建农林大学, 2015. LIN Xianlin. The Effect of 60Co-gamma Ray on the Growth and Development of the Melastoma affine Seedings[D]. Fuzhou: Fujian Agriculture and Forestry University, 2015. (in Chinese) [41] 王文恩, 张俊卫, 包满珠. 核农学报, 2005(3): 191. doi: 10.3969/j.issn.1000-8551.2005.03.007 WANG Wenen, ZHANG Junwei, BAO Manzhu. Journal of Nuclear Agricultural Sciences, 2005(3): 191. (in Chinese) doi: 10.3969/j.issn.1000-8551.2005.03.007 [42] 马兴立, 赵昆昆, 赵品源, 等. 华北农学报, 2019, 34(2): 138. doi: 10.7668/hbnxb.201751301 MA Xingli, ZHAO Kunkun, ZHAO Pinyuan, et al. Acta Agriculturae Boreali-Sinica, 2019, 34(2): 138. (in Chinese) doi: 10.7668/hbnxb.201751301 [43] 陆锡宏, 石广亮, 李雪虎, 等. 原子核物理评论, 2013, 30(4): 477. doi: 10.11804/NuclPhysRev.30.04.477 LU Xihong, SHI Guangliang, LI Xuehu, et al. Nuclear Physics Review, 2013, 30(4): 477. (in Chinese) doi: 10.11804/NuclPhysRev.30.04.477 [44] 廖安红, 陈红. 分子植物育种, 2016, 14(3): 742. LIAO Anhong, CHEN Hong. Molecular Plant Breeding, 2016, 14(3): 742. (in Chinese) [45] GUDKOV S V, GRINBERG M A, SUKHOV V, et al. Journal of Environmental Radioactivity, 2019, 202: 8. doi: 10.1016/j.jenvrad.2019.02.001 [46] ASAHINA M, TAMAKI Y, SAKAMOTO T, et al. Phytochemistry, 2014, 104: 21. doi: 10.1016/j.phytochem.2014.04.017 [47] 悦冲. 山西部分主栽毛桃品种抗寒性及生理指标研究[D]. 太原: 山西师范大学, 2016. YUE Chong. Study on Cold Resistance of Some Varieties of Prunus persica Mainly Planted in Shanxi Province[D]. Taiyuan: Shanxi Normal University, 2016. (in Chinese). [48] WANG S, XIE B, YIN L, et al. Photochemistry and Photobiology, 2010, 86(1): 110. doi: 10.1111/j.1751-1097.2009.00635.x [49] ABDELAAL K A, EL-MAGHRABY L M, ELANSARY H, et al. Agronomy-Basel, 2020, 10(1): 26. doi: 10.3390/agronomy10010026 [50] 陈臻, 徐秉良, 蒲崇建, 等. 核农学报, 2013, 27(5): 552. doi: 10.11869/hnxb.2013.05.0552 CHEN Zhen, XU Bingliang, PU Chongjian, et al. Journal of Nuclear Agricultural Sciences, 2013, 27(5): 552. (in Chinese) doi: 10.11869/hnxb.2013.05.0552 [51] 李璇, 岳红, 黄璐琦, 等. 环境胁迫下植物抗氧化酶的反应规律研究[C]//2010年中国药学大会暨第十届中国药师周论文集, 天津, 2010: 527. LI Xuan, YUE Hong, HUANG Luqi, et al. Study on the Reaction Law of Plant Antioxidant Enzymes Under Environmental Stress[C]//2010 China Pharmaceutical Congress and the 10th Chinese Pharmacists' Weekly Essay Collection, China, 2010: 527. (in Chinese). [52] 胡智. 水稻黄叶基因YL1的图位克隆和功能研究[D]. 扬州: 扬州大学, 2017. HU Zhi. Gene Cloning and Functional Analysis of YLl Conferring the Leaf Color through Characterizing the Rice yll Mutant[D]. Yangzhou: Yangzhou University, 2017. (in Chinese). [53] 李蕊. 不同剂量12C重离子辐射对燕麦的诱变效应[D]. 兰州: 兰州大学, 2014. LI Rui. Mutagenic Effects of Different Doses of 12C Heavy Ion Radiation on Oat[D]. Lanzhou: Lanzhou University, 2014. (in Chinese) [54] 裴斌, 张光灿, 张淑勇, 等. 生态学报, 2013, 33(5): 1386. doi: 10.5846/stxb201209281358 PEI Bin, ZHANG Guangcan, ZHANG Shuyong, et al. Acta Ecologica Sinica, 2013, 33(5): 1386. (in Chinese) doi: 10.5846/stxb201209281358 [55] KORNYEYEV D, LOGAN B A, PAYTON P, et al. Physiologia Plantarum, 2001, 113(3): 323. doi: 10.1034/j.1399-3054.2001.1130304.x [56] 朱雯, 王刚涛, 王益, 等. 经济林研究, 2016, 34(2): 120. ZHU Wen, WANG Gangtao, WANG Yi, et al. Non-wood Forest Research, 2016, 34(2): 120. (in Chinese) [57] 刘青芳, 余丽霞, 杜艳, 等. 辐射研究与辐射工艺学报, 2013, 31(1): 26. LIU Qingfang, YU Lixia, DU Yan, et al. Journal of Radiation Research and Radiation Processing, 2013, 31(1): 26. (in Chinese) [58] 贾俊杰. SH矮砧苹果幼树滴灌条件下需水特性与生理指标响应研究[D]. 太原: 太原理工大学, 2017. JIA Junjie. Study on Water Requirement Characteristics and Physiological Indexes of Young SH Dwarf Apple Trees under Drip Irrigation[D]. Taiyuan: Taiyuan University of Technology, 2017.(in Chinese) [59] 诸姮, 胡宏友, 卢昌义, 等. 厦门大学学报(自然科学版), 2007(S1): 136. ZHU Heng, HU Hongyou, LU Changyi, et al. Journal of Xiamen University (Natural Science), 2007(S1): 136. (in Chinese) [60] 鲁守平, 隋新霞, 孙群, 等. 天然产物研究与开发, 2006(6): 1027. doi: 10.3969/j.issn.1001-6880.2006.06.037 LU Shouping, SUI Xinxia, SUN Qun, et al. Natural Product Research and Development, 2006(6): 1027. (in Chinese) doi: 10.3969/j.issn.1001-6880.2006.06.037 [61] 张英, 吴聪俊. 天然产物研究与开发, 2015, 27(3): 552. ZHANG Ying, WU Congjun. Natural Product Research and Development, 2015, 27(3): 552. (in Chinese) [62] LU N H, ZHANG Y, GAO Z H. Toxicology in Vitro, 2009, 23(4): 627. doi: 10.1016/j.tiv.2009.02.013 [63] ZHU W J, CHEN X Q, YU J F, et al. Biochemical Pharmacology, 2018, 154: 18. doi: 10.1016/j.bcp.2018.04.006 [64] EVERS D L, CHAO C F, WANG X, et al. Antiviral Research, 2005, 68(3): 124. doi: 10.1016/j.antiviral.2005.08.002 [65] 李春艳. 黄芩素抑制人舌鳞癌CAL27细胞增殖的研究[D]. 长春: 吉林大学, 2022. LI Chunyan. Inhibitory Effect of Baicalein on CAL27 Cell Proliferation in Human Tongue Squamous Cell Carcinoma[D]. Changchun: Jilin University. 2022. (in Chinese). [66] 苏彦雷, 刘倩, 王君平, 等. 中华中医药学刊, 2022, 40(8): 14. SU Yanlei, LIU Qian, WANG Junping, et al. Chinese Archives of Traditional Chinese Medicine, 2022, 40(8): 14. (in Chinese) [67] 曾燕, 郭兰萍, 王继永, 等. 中国现代中药, 2015, 17(8): 776. ZENG Yan, GUO Lanping, WANG Jiyong, et al. Modern Chinese Medicine, 2015, 17(8): 776. (in Chinese) [68] 苏雨苗. 60Co-γ射线辐照对穿心莲植株生长及有效成分含量影响的研究[D]. 广州: 广州中医药大学, 2020. SU Yumiao. Effects on Plant Growth and Effective Component Content of Andrographis paniculata Irradiated by 60Co-γ Ray[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2020. (in Chinese). [69] 阎侃, 李雪虎. 西北植物学报, 2015, 35(5): 906. doi: 10.7606/j.issn.1000-4025.2015.05.0906 YAN Kan, Li Xuehu. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(5): 906. (in Chinese) doi: 10.7606/j.issn.1000-4025.2015.05.0906 -




 下载:
下载:











 甘公网安备 62010202000723号
甘公网安备 62010202000723号